Avec une accalmie prolongée, lorsque le tableau clinique est absent pendant un temps impressionnant, il semble à un patient diagnostiqué avec un asthme bronchique que la maladie a reculé et il n'y aura plus d'exacerbations. De plus, l'état de santé ne provoque pas de plaintes et la capacité de travailler reste à un niveau décent.
Mais c'est la « sournoiserie » de la maladie, qu'une crise d'asthme survienne soudainement, sans raison apparente à première vue ou même avec un contact mineur avec l'un ou l'autre allergène.
Alors, est-il possible de prévenir l'exacerbation de l'asthme bronchique ? L'éviter? Ou devriez-vous vous connecter à un processus pluriannuel en progression constante ?
L'essence de la pathologie
L'asthme bronchique – maladie chronique, qui se caractérise par un tableau clinique changeant : l'exacerbation de la maladie est remplacée par une longue pause sans aucun symptôme asthmatique. La pause suit à nouveau période aiguë etc.
Et bien que les sources médicales décrivent souvent l'asthme bronchique comme une maladie inflammatoire qui affecte le système respiratoire (en particulier, l'arbre bronchique) et prescrit un certain nombre de symptômes et de signes de la maladie, le maillon clé de la pathologie est le bronchospasme, souvent appelée obstruction bronchique / crise d'asthme /.

Il se manifeste sous la forme toux sèche douloureuse et improductive, accompagnée d'un inconfort sévère dans coffre, ainsi que la nécessité d'appliquer un effort supplémentaire pour expirer. Oui, en cas d'asthme bronchique, c'est l'expiration qui provoque des difficultés dues à l'œdème des tissus lisses des bronches. Pour soulager son état, le patient au niveau de la machine adopte une posture assez spécifique (orthopnée) : assis, jambes écartées, légèrement penché en avant et posant ses mains sur quelque chose. Dans cette position, il lui est plus facile d'expirer, bien que l'attaque ne le bloque pas.
Comme signes d'exacerbation associés les asthmes bronchiques sont souvent considérés :
- douleur thoracique;
- respiration sifflante en écoutant les bronches;
- respiration affaiblie;
- la libération d'une faible quantité d'expectorations incolores après une attaque de toux;
- fatigue chronique, somnolence;
- tachycardie;
- sensation d'essoufflement.
Pour l'étiologie allergique les maladies peuvent également être observées rhinite, éruptions cutanées, larmoiement, éternuements.
Selon la fréquence et la durée du bronchospasme, les experts identifient 4 principaux degrés de gravité maladies:
- léger intermittent (l'exacerbation de la maladie ne dure pas longtemps, il n'y a pratiquement pas d'attaques nocturnes);
- léger persistant (des processus pathologiques sont observés plusieurs fois par semaine, le bien-être du patient s'aggrave considérablement);
- persistance moyenne (un bronchospasme est observé presque tous les jours, la capacité de travail du patient diminue, la fréquence des obstructions bronchiques la nuit dépasse 1 fois par semaine);
- sévère persistante (les crises d'asthme perturbent tous les jours, le patient a des difficultés à respirer et à se déplacer activement).
La cause de toutes les formes d'exacerbation mentionnées peut être à la fois des processus immunologiques et non immunologiques. Oui, elle est exacerbée par l'exposition à toutes sortes d'allergènes. La non-allergie, à son tour, est souvent provoquée par de nombreux facteurs ménagers ou des problèmes de santé généraux :
- maladies respiratoires fréquentes;
- fatigue physique régulière;
- conditions de travail préjudiciables au travail;
- un changement brutal des conditions météorologiques;
- accueil médicaments;
- tendance à l'alcoolisme, tabagisme;
- annulation soudaine de spécial médicaments traitement de l'asthme bronchique.
Important! Les asthmatiques doivent être extrêmement prudents avec les médicaments, car beaucoup d'entre eux, sans recherche préalable, peuvent non seulement provoquer une exacerbation de la maladie, mais aussi provoquer choc anaphylactique... On l'appelle souvent la forme clinique de la maladie asthmatique, qui, malgré la gravité de la manifestation et la menace réelle pour la vie du patient due à une insuffisance respiratoire totale, peut être arrêtée avec des bloqueurs spéciaux.
La deuxième forme est métabolique, n'est pas si aigu, mais ne se prête pratiquement pas à un soulagement rapide et nécessite une approche plus prudente dans des conditions stationnaires.

Comment soulager rapidement une exacerbation ?
Selon l'origine de la maladie asthmatique, l'algorithme de suppression des symptômes aigus change également.
Oui, pour l'asthme bronchique allergique il suffit d'éliminer l'allergène, ce qui devrait être suivi d'un soulagement significatif de l'état du patient. Cela peut être fait à l'aide d'antihistaminiques spéciaux (sous forme de comprimés, d'injections intramusculaires, d'aérosols).
Pour asthmatique maladies d'origine non allergique sera requis médicaments-bloquants. Ils sont souvent plus populaires sous forme d'inhalateurs, qu'il est conseillé aux patients d'emporter avec eux pour éviter une attaque sévère. Sont tout aussi importants : la thérapie active des maladies système respiratoire pouvant provoquer une crise d'étouffement / toux, rejet des mauvaises habitudes, changement de résidence vers une résidence plus respectueuse de l'environnement, mise en place d'une alimentation correcte.
Lorsque choc anaphylactique le risque de décès est significativement augmenté, ce qui nécessite une ambulance immédiate, à savoir l'administration sous-cutanée d'une solution d'adrénaline.
Dans n'importe quelle situation, le patient doit comprendre que l'obstruction bronchique est vraiment dangereuse et nécessite une utilisation prudente des médicaments, l'évitement des allergènes, le surmenage et les dépressions nerveuses.
Attention! S'armer d'agents d'arrêt, ce n'est pas seulement le patient, mais aussi ses proches. En effet, lors d'une crise aiguë, la panique peut empêcher une personne asthmatique de s'orienter et de se fournir.
Comment traite-t-on une exacerbation?
Cela ne signifie pas un soulagement instantané du bronchospasme ou réaction allergique sur tel ou tel "agent pathogène", à savoir le traitement de l'asthme bronchique. Traitement dont le résultat final devrait être une période de "calme" absolu, longue, sans tableau clinique évident.

De nombreuses sources médicales suggèrent plusieurs "objectifs" officiels ce qu'ils essaient d'atteindre en compilant un algorithme pour éliminer l'exacerbation de la maladie asthmatique :
- élimination efficace des symptômes de la maladie;
- contrôler les symptômes;
- stabilisation du système respiratoire, ventilation pulmonaire;
- augmenter les performances du patient, améliorer son bien-être;
- retrait du syndrome d'obstruction bronchique;
- prochaine exacerbation / Effets secondaires thérapie médicamenteuse active;
- prévention de la mort.
Pour mettre en œuvre chaque élément de cette liste, un plan d'action clair sera nécessaire. Cependant, comme le montre la pratique, sa première moitié est presque identique, quelle que soit l'étiologie de la maladie asthmatique, ainsi que sa gravité :
- consultation spécialisée / visite à domicile de la brigade de garde ;
- examen détaillé du patient (de préférence en milieu hospitalier) : analyses générales(sang/urine), radiographie, ECG, test allergène;
- étude des crises d'exacerbation (leur durée, leur gravité, leurs causes d'occurrence);
- prescrire des médicaments spéciaux, vérifier la réponse du corps à la tolérance individuelle.
Important! Le médecin devra non seulement prescrire des médicaments efficaces, mais aussi apprendre au patient à les utiliser. Oui, si la prise des pilules est facile, alors l'utilisation de l'inhalateur/nébuliseur/aérosol peut soulever des questions, notamment chez les jeunes enfants et les personnes âgées.
Après avoir établi un diagnostic précis, le médecin traitant devra choisir le plus médicaments efficaces pour votre patient, ainsi que de formuler un certain nombre de recommandations. Pour l'asthme bronchique allergique :
- Éliminer l'allergène s'il est déjà connu. Dans certains cas, cela ne peut pas être fait, vous devrez donc observer au moins des mesures de sécurité minimales, ainsi que prendre des antihistaminiques.
- Ayez toujours sur vous un bloqueur d'étouffement sélectionné par un spécialiste. Après tout, assez souvent le système immunitaire l'organisme réagit brusquement non pas à l'allergène lui-même, mais à ses "dérivés".
Pour l'asthme non allergique :
- Éliminer la cause de l'exacerbation de la maladie (guérison maladies respiratoires système respiratoire, abandonner la malbouffe et les addictions, changer de travail/de lieu de résidence, si ce sont leurs conditions environnementales qui ont provoqué la progression de l'asthme bronchique).
- Prenez des médicaments régulièrement, marchez davantage au grand air.
- Limitez l'activité physique, mais n'abandonnez pas du tout.
Comment traiter une exacerbation ?
Cette question ne doit être posée qu'à un spécialiste expérimenté, mais pas à un employé d'une chaîne de pharmacies. De plus, il n'est pas nécessaire de s'impliquer dans la thérapie la médecine traditionnelle sans consulter un médecin au préalable.

Cela ne veut pas dire qu'il est inefficace par rapport à l'asthme bronchique. Non, certains remèdes aideront à prévenir le bronchospasme et d'autres manifestations cliniques maladie, par exemple décoctions racine de réglisse et de thym, bourgeons de pin, fruits de fenouil, jeunes feuilles de lilas, teinturesà partir d'huile d'olive et d'ail.
Mais! Pour ce faire, vous devez être absolument sûr d'une réaction positive du corps à l'un ou l'autre des composants d'une décoction ou d'une teinture cicatrisante.
Le plus rapide s'avérera être remèdes traditionnels:
Attention! Tous les médicaments sont prescrits sur une base individuelle, dosage individuel. De plus, leur efficacité et la présence d'effets secondaires sont strictement contrôlées par des spécialistes.
Un aspect important pour éliminer l'exacerbation de l'asthme bronchique est l'attitude du patient. Après tout, le tableau clinique principal peut être provoqué précisément système nerveux... Pour cette raison, on prescrit au patient du repos, du repos, des complexes vitaminiques pour maintenir tout le corps, une nutrition de haute qualité et thérapie médicamenteuse... Si toutes ces conditions sont réunies, la maladie reculera rapidement, sans forcer à se souvenir d'elle-même.
Vidéo utile
Assurez-vous de regarder la vidéo si vous avez un enfant d'âge scolaire :
En effet, tout patient admis en réanimation avec une exacerbation d'asthme bronchique (AB) est diagnostiqué asthmatique. De telles normes sont énoncées dans la CIM-10, mais cela ne permet pas de juger objectivement de la gravité du processus. Il convient de rappeler que le diagnostic « état de mal asthmatique » (AS) est un terme collectif qui combine différents degrés de gravité de l'exacerbation de l'asthme. Certains experts suggèrent que le terme « AS » cessera d'être pertinent dans les années à venir. Dans les recommandations pour le traitement de l'asthme de l'association GINA (Global Initiative for Asthma) « Statut asthmatique ! pas mentionné.
Mais ce sont ces documents qui ont constitué la base des recommandations russes pour le traitement de l'asthme. La juste détermination par le médecin de la gravité d'une exacerbation de l'asthme bronchique permet d'optimiser le traitement, de trouver les patients qui nécessitent une attention maximale.
Selon les données fournies par les experts du GINA, la Russie se classe au premier rang mondial pour la mortalité due à l'asthme. Certains chercheurs disent que cela est dû non seulement à la qualité des soins, mais plutôt au mauvais diagnostic de la maladie. Les médecins confondent souvent la maladie pulmonaire obstructive chronique (MPOC) avec la MA. Comme vous le savez, l'asthme à long terme est l'une des principales causes de maladie pulmonaire obstructive chronique. Lorsqu'un patient asthmatique a 60 ans ou plus, les médecins ne feront pas d'erreur s'ils reflètent la MPOC dans le diagnostic.
Si l'âge du patient n'est pas supérieur à 35-40 ans, le diagnostic de BPCO peut être exclu. Problème diagnostic différentiel chez les personnes de 40 ans et plus, elle est compliquée par le fait que l'asthme et la BPCO peuvent être observés simultanément. Mais souvent les manifestations de la BPCO, même si le patient n'a jamais été malade l'asthme bronchique sont pris pour l'exacerbation de l'asthme. C'est le pire des cas, car le traitement de ces maladies est très différent.
En outre, ces maladies diffèrent considérablement dans leurs résultats. La BPCO est caractérisée par une progression de la maladie et un manque de réversibilité. Pour la MA, la réversibilité est typique, bonne dynamique positive pour un traitement correctement conduit, parcours vallonné. Il convient de garder à l'esprit que si une exacerbation de l'asthme ne répond pas au traitement décrit ci-dessous, la pathologie principale est très probablement la BPCO.
Causes d'exacerbation de l'asthme bronchique
Le plus souvent, la cause déclenchante est virale, moins souvent - infections bactériennes, conditions environnementales défavorables, divers allergènes, erreurs dans le traitement de l'asthme diagnostiqué.
Inspection et surveillance
Tous les patients subissent une radiographie des poumons. Surveillé pression artérielle, Fréquence cardiaque, gaz du sang, ECG, débit expiratoire de pointe (DEP), électrolytes sanguins, hématocrite, glucose, créatinine, saturation sanguine. Une évaluation dynamique des symptômes cliniques est également réalisée.
Les médecins déterminent la gravité d'une exacerbation selon le tableau:
|
Gravité de l'exacerbation BA |
|||||||||
|
Gravité moyenne |
Potentiellement mortel |
||||||||
|
En marchant |
Quand on parle |
||||||||
|
Les propositions |
|||||||||
|
respiration sifflante |
Souvent seulement à l'expiration |
Souvent bruyant |
Absent |
||||||
|
Position |
Peut mentir |
Je préfère m'asseoir |
Asseyez-vous penché en avant |
||||||
|
Niveau d'éveil |
Parfois excité |
Généralement agité |
Généralement agité |
Inhibé ou esprit confus |
|||||
|
Implication musculaire accessoire dans l'acte de respirer et de couler fosse supraclaviculaire |
Il y a généralement |
Il y a généralement |
Mouvements paradoxaux parois thoraciques et abdominales |
||||||
|
Bradycardie |
|||||||||
|
Augmenté |
Augmenté |
||||||||
|
PSV * mesurer 30-60 minutes après la première injection bronchodilatateur en % du dû ou le meilleur valeur individuelle |
Plus de 80% du dû ou meilleur valeurs individuelles |
60-80% du dû ou meilleur valeurs individuelles |
<60% от должных или наилучших valeurs individuelles (<100 л/мин у взрослых) ou l'effet dure moins de 2 heures |
||||||
|
SpO2,% (lors de la respiration air) |
|||||||||
|
PaO2 (en respirant de l'air) |
Plus de 60 mmHg. De l'art. |
Moins de 60 mm Hg De l'art. Cyanose possible |
|||||||
|
Moins de 45 mmHg De l'art. |
Plus de 45 mmHg De l'art. |
||||||||
|
*Noter. Les valeurs approximatives du débit expiratoire de pointe chez les hommes adultes en bonne santé sont de 500 à 600 l / min, pour les femmes de 350 à 500 l / min. |
|||||||||
Traitement de l'exacerbation de l'asthme bronchique
Quelle que soit la gravité de l'exacerbation de l'asthme, des corticostéroïdes et des bêta-2 agonistes inhalés sont prescrits. Le traitement doit être effectué dans cet ordre:
- Oxygénothérapie
Le patient prend une position assise ou semi-assise forcée. Le médecin traitant doit avertir les infirmières du service de ne pas essayer de mettre le patient en position "couchée".
L'hypoxie est la principale cause de décès dans les exacerbations de l'asthme. Par conséquent, si une personne souffre d'hypoxémie, de l'oxygène doit être prescrit dès que possible. Les médecins ajustent le débit d'oxygène pour s'assurer que le niveau de SpO2 est supérieur à 92 %. Même des concentrations élevées d'oxygène (FiO2> 0,7) dans le mélange respiratoire n'augmentent que de manière insignifiante la PaCO2 et ne conduisent pas à une dépression du centre respiratoire.
- Bronchodilatateurs inhalés
Il convient de rappeler que pour l'administration par inhalation de bronchodilatateurs, un nébuliseur et des aérosols-doseurs peuvent être utilisés avec la même efficacité. Les bronchodilatateurs inhalés sont choisis pour le traitement des exacerbations de l'asthme bronchique de toute gravité. Dans la plupart des cas, seuls les bêta-2 agonistes peuvent être administrés au patient.
Dans les cas graves, l'inhalation de bêta-2-agonistes avec des anticholinergiques est nécessaire. Il est recommandé d'utiliser une combinaison de bêta-2-agoniste + anticholinergique (bromure d'ipratropium) pour l'exacerbation sévère de l'asthme; avec un effet insuffisant du traitement en cours avec des bêta-2-agonistes; chez les patients de plus de 60 ans, et à tout âge, si le médecin a noté des signes de BPCO chez le patient.
Si le patient avant son admission à l'USI n'a pas pris de bêta-2-agonistes comme prescrit par le médecin, ou les a reçus à des doses normales, il est alors préférable de continuer l'inhalation du bêta-2-agoniste qui était auparavant le plus efficace pour traiter ce patient (demandez à lui-même ou à ses proches).
- Utiliser un nébuliseur
La procédure d'inhalation de médicaments via un nébuliseur prend beaucoup de temps et l'hypoxémie est courante chez les patients. Il est donc recommandé d'utiliser un nébuliseur à entraînement pneumatique à partir d'une ligne d'oxygène.
Le plus souvent, ils prennent solutions spéciales pour inhalation:
Agoniste sélectif des récepteurs bêta-2-adrénergiques. Mode d'application : à l'aide d'un nébuliseur ; nébuleuse de 2,5 ml, qui contient 2,5 mg de salbutamol dans une solution saline. 1-2 nébuleuses (2,5-5,0 mg) sont prescrites pour l'inhalation sous forme non diluée. S'il n'y a pas d'amélioration, les médecins répètent les inhalations de 2,5 mg toutes les 20 minutes pendant une heure. Par la suite, 2,5 à 10 mg toutes les 1 à 4 heures au besoin, ou 10 à 15 mg par heure en continu.
1 ml (20 gouttes) de solution pour inhalation contient 500 µg de bromhydrate de phénotérol et 250 µg de bromure d'ipratropium. Vous devez inhaler 1 ml (20 gouttes) de berodual dans 3 à 4 ml de solution physiologique ou une solution à 25 % de sulfate de magnésium pendant 5 à 10 minutes, jusqu'à ce que la solution soit complètement utilisée. S'il n'y a pas d'amélioration, une réinhalation est nécessaire après 20 minutes.
Les médecins se souviennent que le sulfate de magnésium démontre les propriétés d'un bronchodilatateur à la fois lorsqu'il est administré par voie intraveineuse et lorsqu'il est inhalé. Bien que le médicament soit quelque peu inférieur en efficacité à la fois aux bêta-2-agonistes et aux anticholinergiques. Mais si 5 à 8 ml de sulfate de magnésium à 25 % sont utilisés au lieu de chlorure de sodium à 0,9 % comme solvant pour les bêta-2-agonistes, un effet brocholytique articulaire plus prononcé peut être observé.
Bromure d'ipratropium par nébuliseur : 0,5 milligramme toutes les 20 minutes jusqu'à 3 doses, puis au besoin. Pour ce médicament, lorsqu'il est administré par inhalation, une absorption extrêmement faible de la membrane muqueuse des voies respiratoires est typique et, par conséquent, il n'a pas d'effet systémique.
Inhalateurs doseurs
Pour une utilisation efficace des inhalateurs-doseurs, il est important qu'ils soient équipés d'une entretoise, de préférence de grand volume (0,5-1 litre), car certaines personnes ont du mal à coordonner leur inhalation avec inhalation. S'il n'y a pas d'entretoise, elle peut être réalisée assez rapidement à partir d'une bouteille en plastique ordinaire ou de tout autre récipient adapté.
En cas d'exacerbation de l'asthme bronchique, des bêta-2-agonistes à courte durée d'action sont prescrits - sulfate de terbutaline (1 dose - 250 g), salbutamol (1 dose - 100 g), (1 dose - 200 g), Berodual (une dose de berodual contient 0,05 mg de fénotérol et 0,02 mg de bromure d'ipratropium). Initialement, le patient, avec un intervalle de plusieurs secondes entre les inhalations, inhale séquentiellement de quatre à huit doses de l'un des médicaments ci-dessus. Après - 1-2 doses en 10-20 minutes jusqu'à ce que l'état s'améliore ou l'apparition d'effets secondaires - tachycardie, tremblements sévères. Après cela, si nécessaire - 1-2 doses en 1-4 heures.
Inhalation de bromure d'ipratropium à travers un inhalateur-doseur - 8 respirations toutes les 20 minutes, si nécessaire, répéter pendant 3 heures.
Complications
Lors de l'utilisation de bêta-2-agonistes, leurs contre-indications doivent être prises en compte: arythmies cardiaques, hypertension sévère et autres. Vous devez également contrôler la concentration de potassium dans le plasma - une hypokaliémie peut se développer. Si le patient présente des signes de surdosage en bêta-2-agonistes, ils doivent être arrêtés immédiatement. Mais après 4-5 heures, il est nécessaire de recommencer à prendre des médicaments. Les patients présentant une exacerbation de l'asthme doivent prendre ces médicaments jusqu'à ce qu'il y ait une amélioration durable de leur état.
Corticostéroïdes
Il est important de considérer: les corticoïdes sont prescrits à tous les patients présentant une exacerbation de l'asthme bronchique, quelle que soit la gravité, et immédiatement après l'admission, sans délai. Un rôle important dans le développement de l'exacerbation de l'asthme est joué non seulement par le bronchospasme, mais également par l'inflammation, l'œdème, la dyskinésie des petites voies respiratoires et leur colmatage par des expectorations visqueuses. Par conséquent, les corticostéroïdes, qui ont un effet anti-inflammatoire prononcé, sont importants dans le traitement de l'asthme. Les corticostéroïdes peuvent être administrés par voie intraveineuse ou entérale, et l'effet sera le même.
Un effet cliniquement significatif après leur administration se développe après 2-4 heures : en moyenne, après 1-6 heures avec l'administration intraveineuse. Avec administration entérale - un peu plus tard. La recherche suggère que des doses relativement faibles de corticostéroïdes (40 à 80 mg / jour) sont aussi efficaces que des doses relativement élevées de méthylprednisolone - 200 à 300 mg / jour. Il n'a pas été prouvé que l'utilisation de doses très élevées (thérapie par le pouls) de prednisolone (1-2 g par jour) peut améliorer les résultats de la thérapie. C'est-à-dire qu'il y a une sorte d'effet de seuil.
Les patients présentant une exacerbation légère à modérée peuvent se voir attribuer une voie d'administration entérale ou par inhalation. La méthode de choix est la méthylprednisolone ou la prednisolone par voie entérale à la dose de 60 à 80 mg par jour pour 1 à 3 doses. Pour les exacerbations sévères ou potentiellement mortelles de l'asthme, il est préférable d'utiliser la voie intraveineuse d'administration de corticostéroïdes.
La plupart des experts choisissent une dose de 1,5 à 2 mg/kg par jour de prednisolone IV, répartie en 4 prises. Le lendemain, l'administration du médicament doit être répétée - à la même dose et avec la même fréquence d'administration. Les jours suivants, la dose de prednisolone doit être réduite - de 60 à 90 mg par jour par voie intraveineuse ou entérale pendant 5 à 7 jours ou jusqu'à ce que l'état de la personne soit stable.
Au lieu de la prednisolone avec pratiquement la même efficacité, la dexaméthasone 4 mg IV 3 fois par jour peut être attribuée, ou l'hydrocortisone 125-250 mg IV 4 fois par jour. Par rapport à la prednisone, la dexaméthasone a un effet biologique plus long. Pour cette raison, la durée du cours peut être aussi courte que 4-5 jours. Il n'est pas nécessaire de réduire progressivement la dose. Il convient de rappeler: en cas d'exacerbation sévère, les corticostéroïdes inhalés ne sont prescrits par les médecins qu'après une amélioration constante de l'état du patient.
Sulfate de magnésium
L'administration intraveineuse de sulfate de magnésium a été incluse dans toutes les recommandations en tant que traitement secondaire, à la fois chez les patients adultes et chez les enfants. Le sulfate de magnésium est prescrit en cas d'effet insuffisant de l'utilisation de bêta-2-agonistes; avec exacerbation sévère de l'asthme bronchique, dans lequel il existe une obstruction bronchique sévère.
Avant la nomination du sulfate de magnésium, l'hypovolémie doit être éliminée, la PAS doit être supérieure à 100 mm Hg. De l'art. Important: si une personne présente une exacerbation potentiellement mortelle, le sulfate de magnésium n'est prescrit qu'une fois que la personne est transférée vers une respiration contrôlée et une stabilisation hémodynamique.
La plupart des experts conseillent l'introduction de 2 g de sulfate de magnésium en 20 minutes. Selon l'opinion subjective de certains chercheurs, une telle technique d'introduction du sulfate de magnésium est efficace : 20 ml d'une solution à 25 % (5 grammes) sont administrés par voie intraveineuse pendant 15 à 20 minutes, puis en perfusion intraveineuse à raison de 1 à 2 g par heure jusqu'à l'élimination du bronchospasme. Dans le même temps, selon les chercheurs, ils n'ont jamais observé d'augmentation du taux de magnésium dans le sang au-dessus du niveau thérapeutique - 2 à 4 mmol par litre. La nomination de sulfate de magnésium doit être prudente si une personne présente des symptômes d'insuffisance rénale ou d'hypotension.
Traitements supplémentaires pour le bronchospasme
Les médicaments suivants ne sont pas systématiquement prescrits. S'il n'y a pas de bronchodilatateurs inhalés, un effet suffisant de la thérapie par inhalation, ou si le patient est incapable de l'exécuter efficacement, les médecins utilisent l'administration intraveineuse de bêta-2-agonistes: salbutamol (dose de charge et d'entretien), épinéphrine (adrénaline). Aujourd'hui, les médecins n'utilisent pas (Euphyllin) pour le traitement de l'exacerbation de l'asthme, car elle provoque un certain nombre d'effets secondaires graves, notamment des tremblements, une tachycardie et des selles molles.
En cas d'exacerbation sévère, l'aminophylline a l'effet souhaité dans de tels cas:
- Si dans les 2 heures suivant la nomination des bêta-2-agonistes, l'administration intraveineuse de sulfate de magnésium, il n'y a pas d'effet positif visible;
- S'il n'est pas possible d'utiliser des bronchodilatateurs inhalés.
Thérapie respiratoire
En plus du traitement médicamenteux, de nombreux patients ont besoin d'une ventilation mécanique.
Ventilation non invasive (VNI)
Certains chercheurs ont de grands doutes sur l'opportunité d'utiliser la VNI chez les patients présentant une exacerbation mortelle de l'asthme bronchique. Mais selon les passionnés utilisant cette méthode dans l'état de mal asthmatique, dans de nombreux cas, il était possible d'éviter l'intubation trachéale et la ventilation mécanique invasive.
Ventilation artificielle (mécanique) des poumons
La ventilation commence dans les conditions suivantes :
- L'apparition de précurseurs du coma (cyanose, somnolence, confusion) ;
- Absence d'effet du traitement actuellement utilisé ;
- Poitrine muette, cyanose, respiration faible;
- L'augmentation de l'hypercapnie de plus de 60 mm Hg. De l'art. dans le contexte de l'hypoxémie (PaO2 55-65 mm Hg, SpO2 moins de 90%.)
- Bradycardie ou hypotension artérielle ;
- Fatigue croissante et épuisement du patient;
- Le débit expiratoire de pointe est inférieur à 30 % de la valeur habituelle du patient.
Technologie de ventilation
Il est préférable de perfuser des solutions salines dans un volume de 400 à 800 ml avant le tout début de la ventilation mécanique pour réduire le risque d'hypotension. Après l'intubation et le début de la ventilation mécanique, en raison d'un surgonflage des alvéoles, d'une augmentation de la pression intrathoracique et d'une auto-PEP élevée, il existe une forte probabilité d'une forte diminution du remplissage du ventricule droit en sang. La conséquence sera le développement de l'hypotension. Il est nécessaire de fournir les premiers soins immédiats à l'avance pour préparer une solution de travail de catécholamines (généralement de l'épinéphrine (adrénaline) - diluer 1 mg d'épinéphrine dans 10,0 de chlorure de sodium à 0,9%). En cas d'hypotension, il est recommandé d'injecter 0,5 à 1 ml par voie intraveineuse.
Préoxygénation. L'intubation trachéale est mieux réalisée avec une inhalation d'oxygène à 100 %. Pour réduire la résistance à l'expiration, les médecins utilisent une sonde endotrachéale du plus grand diamètre pour une personne donnée.
L'induction est réalisée - 1-2 mg pour 1 kg de corps du patient ou propofol - 1-3 mg / kg. Pour la sédation au cours des 2 à 4 premières heures, il est préférable d'utiliser une perfusion de kétamine de 2 à 4 mg/kg/heure, car elle a un effet brocholytique plus prononcé que les autres hypnotiques. Après une certaine stabilisation du patient et réduction du bronchospasme, une infusion de kétamine, de propofol ou de leur mélange (kétofol) est généralement utilisée pour la sédation.La succinylcholine 1,5 mg/kg est généralement utilisée comme relaxant musculaire pour l'intubation.
La durée de la ventilation mécanique est de 3 à 8 heures pour la plupart des patients présentant une exacerbation potentiellement mortelle et ne dépasse généralement pas 2 à 3 jours. Les critères de transfert du patient en respiration spontanée sont classiques : hémodynamique stable, conscience claire du patient, pression inspiratoire dans le système patient-respirateur inférieure à 25 mm d'eau. Art., la PaO2 est supérieure à 65 mm Hg. Art., SpO2 plus de 90% avec FiO2 30-40%., il y a une respiration spontanée d'une personne.
Thérapie par perfusion
Cette méthode est pertinente si le patient ne peut pas boire de l'eau seul ou si le médecin enregistre des signes de déshydratation, d'hypotension. Les patients ont souvent une insuffisance ventriculaire droite, donc l'hypervolémie et de grands volumes de liquide sont contre-indiqués.
La perfusion à l'aide de solutions salines standard est effectuée: avant le début de la ventilation mécanique, dans un volume de 2-3 litres par jour par voie intraveineuse pendant la ventilation mécanique, si l'introduction du tube d'aliments et de liquide n'est pas effectuée.
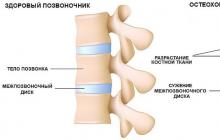
Sous exacerbation de l'asthme bronchiquecomprendre les épisodes d'augmentation progressive de la dyspnée expiratoire, de la toux, de la respiration sifflante ou de diverses combinaisons de ces symptômes.
Les exacerbations se caractérisent par une augmentation progressive de l'obstruction bronchique, qui s'apprécie par la modification du volume expiratoire forcé en 1 s. (VEMS) ou débit expiratoire de pointe (DEP), ainsi qu'une augmentation de la variabilité du DEP avec un suivi quotidien de cet indicateur. Ces indicateurs reflètent plus objectivement la gravité de l'exacerbation de l'asthme que les symptômes cliniques.
Classification de la gravité de l'exacerbation de l'asthme bronchique : Par gravité, vous pouvez distinguer les exacerbations légères, modérées et sévères de l'asthme.
Aggravation légère : l'activité physique est préservée, essoufflement lors de la marche, de la parole - phrases, le patient peut être agité, la fréquence respiratoire est augmentée, les muscles auxiliaires ne sont généralement pas impliqués dans l'acte respiratoire, il y a peu de sifflements sifflants lors de l'auscultation des poumons , généralement à la fin de l'expiration, la fréquence cardiaque est inférieure à 100 par minute , le pouls paradoxal est absent ou inférieur à 10 mm Hg. Art., le débit expiratoire de pointe (PSV) après la prise d'un bronchodilatateur est supérieur à 80% des valeurs appropriées ou individuellement les meilleures pour le patient, l'oxygène Ra est la norme, le test n'est généralement pas nécessaire, le dioxyde de carbone Ra est moins de 45 mmHg. De l'art. (selon les recommandations des experts EPR-2 - 42 mm Hg), Sa (saturation) en oxygène est supérieur à 95 pour cent.
Exacerbation modérée : l'activité physique est limitée, essoufflement en parlant, en parlant - phrases, le patient est généralement agité, la fréquence respiratoire est augmentée, les muscles auxiliaires sont le plus souvent impliqués dans l'acte de respirer, lors de l'auscultation des poumons - râles bruyants et sifflants tout au long de l'expiration, fréquence cardiaque - 100-120 par minute, il peut y avoir un pouls paradoxal de 10-25 mm Hg, débit expiratoire de pointe (PSV) après avoir pris un bronchodilatateur 60-80 pour cent des valeurs appropriées ou individuellement meilleures pour le patient (selon les recommandations des experts EPR-2 - 50-80 pour cent), Ra oxygène plus de 60 mm Hg, Ra dioxyde de carbone moins de 45 mm Hg, Sa oxygène 91-95 pour cent.
Exacerbation sévère : l'activité physique est fortement réduite ou absente, essoufflement au repos, discours familier - mots séparés, le patient est agité, la fréquence respiratoire est supérieure à 30 par minute, les muscles auxiliaires sont toujours impliqués dans l'acte respiratoire, lors de l'auscultation de les poumons - râles bruyants et sifflants pendant l'inspiration et l'expiration, fréquence cardiaque supérieure à 120 par minute, pouls paradoxal supérieur à 25 mm Hg. Art., le débit expiratoire de pointe (PSV) après la prise d'un bronchodilatateur est inférieur à 60% des valeurs appropriées ou individuellement meilleures pour le patient (selon les recommandations EPR-2, moins de 50%) ou 100 litres par minute ou la réponse dure moins de 2 heures, Ra oxygène inférieur à 60 mm Hg, cyanose est possible, Ra de dioxyde de carbone est supérieur à 45 mm Hg, Sa d'oxygène est inférieur à 90 pour cent.
Exacerbation menaçant le pronostic vital : l'activité physique est fortement réduite ou absente, l'essoufflement au repos, la parole est absente, les troubles de la conscience (étourdissement ou stupeur, il peut y avoir un coma), la fréquence respiratoire est augmentée ou diminuée, la participation des muscles auxiliaires à l'acte de respiration - mouvements thoraco-abdominaux paradoxaux, sifflement lors de l'auscultation des poumons respiration sifflante absente, respiration peu profonde, poumon "muet", bradycardie, l'absence de pouls paradoxal indique une fatigue musculaire, le débit expiratoire de pointe après la prise d'un bronchodilatateur est inférieur à 33 pour cent des valeurs appropriées ou individuellement les meilleures pour le patient, Ra oxygène inférieur à 60 mm Hg, cyanose , Ra dioxyde de carbone plus de 45 mm Hg, Sa oxygène moins de 90 pour cent.
La présence de plusieurs paramètres (pas forcément tous) permet de donner une description générale de l'exacerbation. Beaucoup de ces paramètres n'ont pas été systématiquement étudiés et ne sont donc qu'indicatifs.
Il convient de noter que la gravité de l'exacerbation n'est pas synonyme de la gravité de l'évolution de l'asthme bronchique, bien qu'il existe un certain lien entre elles. Ainsi, une forme bénigne d'exacerbation, en règle générale, se caractérise par des maladies bénignes. Dans l'asthme modéré à sévère, des exacerbations légères, modérées et sévères peuvent survenir.
La tactique de traitement de l'asthme bronchique est déterminée par le stade auquel il est effectué: domicile, ambulance, hôpital.
L'algorithme de traitement de l'exacerbation de l'asthme bronchique, quelle que soit sa gravité, repose sur plusieurs principes généraux :
1. Lors de l'examen initial, il est nécessaire d'évaluer la gravité de l'attaque, d'effectuer une mesure de débit de pointe, si possible, une oxymétrie de pouls (à l'hôpital - ECG, radiographie, étude du potassium sérique, des gaz du sang).
2. Effectuer un examen physique pour évaluer la gravité de l'exacerbation et identifier les complications possibles (pneumothorax, pneumomédiastin, atélectasie, pneumonie, etc.).
3. Déterminer la nature du traitement antérieur (le nombre de doses du bronchodilatateur, la voie d'administration, le temps écoulé depuis la dernière administration du bronchodilatateur, si des glucocorticoïdes (GCS) ont été utilisés, leurs doses).
4. Préciser la durée de l'exacerbation et ses causes possibles, une hospitalisation antérieure pour asthme bronchique, la présence d'états asthmatiques (ou d'exacerbations sévères d'asthme) dans l'anamnèse.
5. Supprimer les allergènes causaux ou les déclencheurs d'exacerbation (s'ils sont connus).
6. Mener un traitement d'urgence, en fonction de la gravité de l'exacerbation. Au cours du traitement et de la surveillance, la sévérité de l'exacerbation peut être révisée.
7. Observation en dynamique des symptômes cliniques, surveillance du débit expiratoire de pointe (PSV), oxygène Sa, gaz du sang.
8. Apprendre au patient à utiliser un nébuliseur et un aérosol-doseur.
Au cours de l'examen, une attention particulière est accordée à la présence de signes chez le patient indiquant le développement d'une exacerbation sévère ou potentiellement mortelle de l'asthme - troubles de la conscience, essoufflement sévère, en raison desquels le patient ne prononce que des mots simples ou des phrases courtes, participation dans la respiration des muscles auxiliaires, pâleur, cyanose, absence de bruit respiratoire à l'auscultation, emphysème sous-cutané, pouls paradoxal supérieur à 25 mm Hg. De l'art. (en cas d'urgence, le pouls paradoxal est déterminé par le premier ton de Korotkov à la hauteur inspiratoire et à la profondeur expiratoire - si la différence est supérieure à 12 mm Hg, alors le pouls paradoxal est considéré comme positif), le débit expiratoire de pointe ( PSV) est inférieur à 50-60 pour cent de la valeur due ou la meilleure valeur pour le patient, ou inférieur à 100 litres par minute.
Si l'état initial du patient est évalué comme léger ou modéré, il est nécessaire de commencer l'inhalation de bêta-2 agonistes soit par un inhalateur-doseur avec un espaceur de grand volume (dose initiale 400-800 μg), soit par un nébuliseur (initiale dose 2,5-5 mg) ... 15 à 20 minutes après l'inhalation, une conclusion est tirée sur la gravité de l'exacerbation de l'asthme bronchique.
Algorithme pour le traitement de l'exacerbation légère de l'asthme bronchique au stade "soins ambulatoires - ambulance"
Si, selon les critères, l'état du patient est évalué comme étant léger (la PSV est supérieure à 80 % de la valeur appropriée ou la meilleure individuellement 20 minutes après l'inhalation de 400 μg d'un bêta-2 agoniste à courte durée d'action via un espaceur ou 2,5 mg par nébuliseur, il n'y a pas de respiration sifflante ou d'essoufflement, l'effet des bêta-2 agonistes dure 4 heures).
En cas d'exacerbation légère, le patient peut effectuer seul le traitement de l'exacerbation selon un plan établi à l'avance (de préférence une observation médicale au cours des deux ou trois premiers jours).
En cas d'exacerbation d'un asthme bronchique léger, il est recommandé :
1. Continuer l'inhalation de bêta-2 agonistes toutes les 3 à 4 heures pendant 1 à 2 jours.
2. Pour la prévention des crises de dyspnée, il est nécessaire de prescrire ou de modifier un traitement anti-inflammatoire : corticoïdes inhalés à doses moyennes ou élevées, si le patient n'en a pas reçu auparavant, ou une augmentation de la dose de glucocorticoïdes inhalés de 2 fois , si le patient les a déjà pris.
3. Le patient doit être sous la surveillance ambulatoire d'un pneumologue ou d'un thérapeute pour surveiller l'efficacité du traitement.
Algorithme pour le traitement de l'exacerbation modérée aux stades "soins ambulatoires - ambulance"
Si, selon les critères, l'état du patient est évalué comme modéré (PSV est supérieur à 50 %, mais inférieur à 80 % de la valeur appropriée ou individuellement meilleure après inhalation de 400 µg d'un bêta-2 agoniste à courte durée d'action par un spacer ou 2,5 mg par nébuliseur), le patient :
1. Continuer l'inhalation des bêta-2 agonistes à l'aide d'un nébuliseur (2,5 mg) ou d'un inhalateur-doseur avec un espaceur de grand volume (400 g) trois fois en une heure.
2. Prescrire des stéroïdes systémiques (30-60 mg une fois).
Avec une tendance positive en une heure (PSV est supérieur à 80% de la valeur appropriée ou meilleure individuellement), le patient peut être laissé à la maison.
Le patient doit :
1. Continuer l'inhalation de bêta-2 agonistes 2,5 mg par nébuliseur ou 400 μg par espaceur toutes les 4 heures pendant 2 jours.
2. Prenez des stéroïdes systémiques à une dose de 40 à 60 mg en une ou deux doses pendant 3 à 10 jours.
Si le patient a déjà reçu des corticoïdes inhalés, il est recommandé de doubler leur dose. Si le patient n'a pas pris de corticostéroïdes inhalés, il est alors nécessaire de commencer à les prendre à des doses moyennes ou élevées.
Le patient doit être surveillé pendant 3 à 7 jours, car la probabilité d'une exacerbation répétée persiste.
Si, dans l'heure qui suit, avec une exacerbation modérée, l'effet du traitement est incomplet ou absent, le patient doit immédiatement consulter un médecin et doit être hospitalisé dans le service de pneumologie ou dans l'unité de soins intensifs.
Lors du transport d'un patient dans une ambulance, les inhalations de bêta-2 agonistes sont poursuivies, des inhalations d'atrovent sont ajoutées, qui sont administrées à l'aide d'un nébuliseur (0,5 mg) ou d'un espaceur (4 à 8 respirations) toutes les 30 minutes 3 fois, puis toutes les 2 à 4 heures au besoin. Vous pouvez mélanger le salbutamol et l'atrovent dans le même nébuliseur. Oxygénothérapie si possible.
Algorithme pour le traitement de l'exacerbation sévère aux stades "soins ambulatoires - ambulance - hôpital"
Si, dans une autre heure avec une exacerbation modérée, l'effet du traitement est incomplet ou absent, si initialement ou après la première heure de traitement, il est conclu que le patient alourd(PSV inférieur à 50-60% du dû, fréquence respiratoire supérieure à 25 par minute, fréquence cardiaque supérieure à 110 par minute, essoufflement pendant la conversation - incapacité à prononcer une phrase, phrase sur une expiration) oumortelle (PSV inférieur à 33% du dû, "poumon muet", cyanose, effort respiratoire faible, bradycardie ou hypotension, faiblesse générale, confusion ou coma) exacerbations, alors le patient doit immédiatement consulter un médecin et doit être hospitalisé au niveau pulmonaire ou unité de soins intensifs...
Les indications d'hospitalisation des patients souffrant d'asthme bronchique sont :
1. exacerbation de l'asthme bronchique modéré en l'absence d'effet du traitement dans l'heure.
2. Exacerbation sévère et potentiellement mortelle de l'asthme bronchique 3. Absence de conditions pour la prestation de soins qualifiés et l'observation du patient en dynamique au stade ambulatoire.
4. Patients à risque d'évolution défavorable de la maladie.
Lors de la collecte d'une anamnèse chez un patient présentant une exacerbation de l'asthme bronchique, il est nécessaire d'analyser attentivement la présence de facteurs associés au développement d'une exacerbation potentiellement mortelle (groupe à risque d'issue défavorable).
Ceux-ci inclus:
1. Antécédents d'exacerbation potentiellement mortelle de l'asthme bronchique.
2. Antécédents d'épisode de ventilation mécanique pour exacerbation d'asthme bronchique.
3. Antécédents de pneumothorax ou de pneumomédiastin.
4. Hospitalisation ou traitement médical d'urgence au cours du dernier mois.
5. Plus de deux hospitalisations au cours de la dernière année.
6. Plus de trois appels pour des soins médicaux d'urgence au cours de la dernière année.
7. Utilisation de plus de 2 boîtes de bêta-agonistes à courte durée d'action au cours du dernier mois.
8. Diminution récente ou arrêt complet des corticoïdes.
9. La présence de maladies concomitantes (par exemple, des maladies du système cardiovasculaire ou une maladie pulmonaire obstructive chronique).
10. Problèmes psychologiques (déni de la maladie).
11. Facteurs socio-économiques (faibles revenus, indisponibilité de médicaments).
12. Faible adhésion au traitement.
Traitement de l'exacerbation en milieu hospitalier.
En cas d'exacerbation sévère et potentiellement mortelle, l'état du patient est évalué toutes les 15 à 30 minutes.
Le suivi des patients comprend :
1. Évaluation des symptômes cliniques
2. Détermination du PSV ou du FEV1
3. Détermination de l'oxygène Sa et de la composition des gaz du sang artériel à moins de 92 % d'oxygène Sa
4. Détermination de l'état acido-basique
5. Détermination de la teneur en potassium dans le sérum sanguin
6. ECG
7. Radiographie des organes thoraciques (à l'admission).
La mise en route du traitement ne doit pas être retardée en raison des mesures de laboratoire. L'anamnèse et l'examen physique du patient lors d'une exacerbation sont importants pour le choix du traitement ultérieur.
Lors de l'examen initial du patient, il est nécessaire:
1. Évaluer la gravité de l'exacerbation, effectuer une mesure de débit de pointe avec détermination du PSV.
2. Déterminer la nature du traitement antérieur : bronchodilatateurs, glucocorticoïdes et leurs doses.
3. Préciser la durée de l'exacerbation et ses causes possibles, précédant l'hospitalisation pour asthme bronchique, la présence d'un statut asthmatique (ou TOA) dans l'anamnèse.
4. Effectuer un examen physique pour évaluer la gravité de l'exacerbation et identifier les complications possibles (pneumothorax, pneumomédiastin, atélectasie, etc.).
L'inhalation constante d'oxygène humidifié à l'aide de cathéters nasaux ou de masques Venturi (oxygène Fi 40-60%) est nécessaire jusqu'à ce que la saturation en oxygène soit supérieure à 90%.
Continue ou commence (si le patient n'a pas été assigné auparavant) à prendre des corticostéroïdes systémiques.
Les indications pour la nomination de GCS pour l'exacerbation de l'asthme sont:
1. Inefficacité de l'utilisation des bêta-agonistes à courte durée d'action.
2. Exacerbations de l'asthme modérées, sévères ou potentiellement mortelles.
3. Patients hormono-dépendants.
1. Les experts EPR-2 recommandent de prescrire des corticostéroïdes systémiques (prednisone, prednisolone, méthylprednisolone) 120-180 mg/jour par voie orale en trois ou quatre doses pendant 48 heures, puis 60-80 mg/jour jusqu'à ce que le PSV atteigne 70 % de la valeur appropriée ou individuellement meilleur indicateur, après quoi 40 à 60 mg par jour sont conservés par voie orale en une ou deux doses. Il est possible d'utiliser 200 mg d'hydrocortisone par voie intraveineuse.
2. Les Sociétés thoraciques britannique et canadienne recommandent d'autres doses : 30-60 mg/jour de prednisolone orale ou d'hydrocortisone 200 mg IV toutes les 6 heures. La dose quotidienne prescrite du médicament est maintenue sans diminution pendant 7 à 14 jours ou jusqu'à ce que les symptômes nocturnes de l'asthme bronchique disparaissent, l'activité physique se normalise, le PSV augmente jusqu'aux meilleures valeurs pour le patient (80% de l'indicateur maximal ), suivie d'une annulation en une seule étape du médicament (si le patient n'a pas déjà reçu de corticostéroïdes systémiques comme traitement de base). Dans le même temps, la possibilité d'un retrait en une étape du médicament avec une durée de thérapie GCS de 15 jours ou moins est particulièrement indiquée.
En tant que traitement bronchodilatateur, une combinaison de bêta-2 agonistes et d'anticholinergiques est utilisée, qui sont administrés via un nébuliseur ou un espaceur toutes les 20 minutes pendant une heure supplémentaire.
Si 20 minutes après la dernière inhalation de PSV plus de 50 % de la valeur appropriée ou optimale individuelle du patient, l'état clinique du patient s'est amélioré, alors l'inhalation de ventoline (éventuellement en association avec des anticholinergiques) est poursuivie à 2,5 mg via un nébuliseur ou 400 g à travers un espaceur toutes les heures jusqu'à ce que le PSV dépasse 60 à 70 % de l'échéance, puis 2,5 mg toutes les 6 heures (4 fois par jour).
Si 20 minutes après la dernière inhalation de ventoline PSV reste à moins de 50 % de la valeur appropriée ou individuellement meilleure pour le patient, alors répétez l'inhalation de ventoline (une association avec des anticholinergiques est possible) 2,5 mg via un nébuliseur ou 400 μg via un entretoise toutes les 20 minutes en moins d'une heure.
Si, 15 à 20 minutes après la dernière inhalation, le PSV reste inférieur à 50 % de la valeur appropriée ou optimale pour le patient, alors le patient doit être hospitalisé en unité de soins intensifs.
Les indications de transfert du patient en réanimation sont :
1. Exacerbation sévère de l'asthme bronchique (en l'absence d'effet du traitement effectué dans les 2-3 heures).
2. Exacerbation potentiellement mortelle de l'asthme bronchique avec apparition de signes d'arrêt respiratoire imminent ou de perte de conscience.
Thérapie en unité de soins intensifs :
1. Oxygénothérapie.
2. Administration de bêta-2 agonistes par inhalation (toutes les 4 à 6 heures).
3. Glucocorticoïdes par voie orale (si le patient peut avaler) ou par voie parentérale.
4. Aminophylline par voie intraveineuse 5-6 mg / kg toutes les 10-30 minutes (la dose est réduite si le patient a pris des préparations de théophylline avant l'admission), puis la dose est réduite à 0,6-1,0 mg / kg (720 mg / jour, maximum par jour dose 2g).
5. Peut-être l'introduction de bêta-agonistes parentéraux.
6. Si le traitement est inefficace, une assistance respiratoire est indiquée.
Indications de la ventilation pulmonaire artificielle (VLA) :
1. Obligatoire - troubles de la conscience, arrêt cardiaque, arythmies cardiaques mortelles.
2. Facultatif - augmentation de l'hypercapnie et de l'acidose respiratoire (pH inférieur à 7,15), hypoxémie réfractaire, dépression respiratoire, agitation, fatigue prononcée des muscles respiratoires.
En raison du nombre élevé de complications et de mortalité des patients atteints d'ATO pendant la ventilation mécanique, il est recommandé de mettre en œuvre la tactique d'hypoventilation contrôlée (hypercapnie permissive), dont la tâche est de maintenir strictement la pression expiratoire finale du "plateau" non supérieur à 30 cm H2O malgré la détérioration du pH et du dioxyde de carbone Pa Les paramètres initiaux de l'assistance respiratoire doivent être le choix d'un mode volumétrique avec un volume courant de 6-8 ml/kg, une fréquence de ventilation de 6-10 par 1 min, un débit inspiratoire de 80-100 l/min de bicarbonate.
Critères de transfert de l'unité de soins intensifs :
1. Soulagement complet de l'état de mal asthmatique (exacerbation sévère ou potentiellement mortelle de l'asthme bronchique.
2. Réduction de la gravité de l'exacerbation de l'asthme bronchique (VPN inférieure à 25 par minute, fréquence cardiaque inférieure à 110 par minute, PSV supérieure à 250 litres par minute ou supérieure à 50 % de la valeur appropriée, Ra oxygène supérieur à 70 mm Hg ou Sa oxygène plus de 92%.
Sortie de l'hôpital.
Le patient doit se voir prescrire les médicaments recommandés à la sortie au moins 12 heures (de préférence 24 heures) avant que le patient ne quitte l'hôpital.
Ce faisant, il est nécessaire de s'assurer que ce traitement contrôle l'évolution de la maladie :
1. La nécessité d'utiliser des bêta-2 agonistes à courte durée d'action inhalés pas plus souvent que toutes les 4 heures.
2. L'activité physique normale du patient.
3. Le patient ne se réveille pas la nuit ou tôt le matin.
4. Les signes cliniques sont normaux ou proches de la normale.
5. Après avoir pris des agonistes bêta 2 à courte durée d'action inhalés PSV et FEV1 plus de 70 à 80 % des valeurs correctes ou optimales du patient
6. La dispersion quotidienne du PSV est inférieure à 20 %. Dans le même temps, il convient de noter que chez certains patients, les valeurs de PSV peuvent augmenter lentement jusqu'au niveau approprié (en particulier pour la disparition des creux matinaux), tandis que tous les autres critères confirment l'opportunité de la décharge.
7. Le patient sait comment utiliser correctement le dispositif d'administration de médicament recommandé.
8. Le patient reçoit des stéroïdes oraux et inhalés en plus des bronchodilatateurs.
9. Le patient comprend comment être traité après sa sortie.
10. Le patient a un débitmètre de pointe qu'il sait utiliser.
11. Le patient a un plan d'action écrit pour une exacerbation de l'asthme.
Après sa sortie de l'hôpital, le patient doit être sous la supervision d'un thérapeute ou d'un pneumologue local pendant 4 à 6 semaines.
Ainsi, les diagnostics et la thérapie modernes de l'exacerbation de l'asthme bronchique comprennent une évaluation de la gravité de l'état du patient à l'aide d'indicateurs de perméabilité bronchique, la nomination de bêta-2 agonistes et d'anticholinergiques administrés par nébuliseur ou par inhalateur-doseur avec un grand -espaceur de volume, au lieu d'Euphyllin comme agent de première intention pour le soulagement de l'obstruction bronchique.
Espérons que l'introduction généralisée de ces méthodes dans la pratique clinique augmentera l'efficacité du traitement des exacerbations de l'asthme bronchique.
STATUT ASTMATIQUE.
Un état asthmatique est une crise d'asthme "inhabituelle" de sévérité, résistante au traitement habituel pour le patient avec des bronchodilatateurs. La formation de cette résistance est associée à un blocage fonctionnel progressif des récepteurs b-adrénergiques. De plus, un trouble prononcé du transport mucociliaire est d'une grande importance dans la survenue de l'état de mal asthmatique.
Une condition asthmatique est un asthme bronchique exacerbé prolongé, qui repose sur le processus d'obstruction bronchique (mucobronchostasis) et les syndromes cliniques qui en résultent : respiratoire, hémodynamique et « encéphalopathie hypoxique ».
ETIOLOGIE DU STATUT ASTMATIQUE
Parmi les principaux facteurs conduisant au développement de la SA figurent : l'exposition massive aux allergènes, l'infection des bronches ou des sinus, les maladies infectieuses, les erreurs de traitement des patients, le stress psycho-émotionnel (stress), les influences météorologiques défavorables. Dans près de la moitié des cas, il n'est pas possible d'établir la cause de la SA. Plus de la moitié des cas de SA sont diagnostiqués chez des patients souffrant d'asthme bronchique corticodépendant.
Les erreurs tactiques dans le traitement médicamenteux chez les patients souffrant d'asthme bronchique dans près de 70% des cas deviennent les raisons du développement de la SA. L'arrêt injustifié ou rapide des glucocorticoïdes est à l'origine de la SA dans 17 à 24 % des cas.
De plus, dans 16,5 à 52,3 % des observations, le développement de la SA est facilité par l'utilisation incontrôlée de sympathomimétiques inhalés. Le syndrome de « rebond » observé et bien étudié est caractérisé par une aggravation progressive des crises d'asthme due à l'action bronchoconstrictrice des métabolites accumulés des agonistes bêta-adrénergiques. L'annulation de l'inhalation de sympathomimétiques empêche le développement de la SA. Cependant, il convient de noter qu'il est nécessaire de faire la distinction entre le syndrome de "rebond" et la détérioration de l'état des patients en raison de l'inefficacité de la thérapie par inhalation avec des sympathomimétiques en raison d'une obstruction bronchique sévère ou d'une mauvaise manœuvre respiratoire lors de l'inhalation. Le développement de l'état de mal asthmatique peut également être déclenché par la prise d'anti-inflammatoires non stéroïdiens, les bêta-bloquants.
PATHOGENESE DE L'ETAT ASTMATIQUE
L'élément principal de la physiopathologie de la SA est une obstruction bronchique prononcée causée par un œdème de la paroi bronchique, un bronchospasme, une altération du drainage bronchique et une obstruction des bronches par des bouchons muqueux. Tout cela entraîne des difficultés d'inspiration, d'activation et d'allongement de l'expiration, qui sont enregistrées comme une diminution de la CV, de la CVF, du VEMS et du débit expiratoire de pointe (PSV).
En plus de l'obstruction bronchique sévère dans la pathogenèse de la SA, le "surgonflage" des poumons joue un rôle important. À l'inspiration, une certaine expansion des bronches se produit et le patient inhale plus d'air qu'il n'a le temps d'expirer par les voies respiratoires rétrécies et obturées avec une sécrétion trachéobronchique visqueuse. Les tentatives du patient d'expirer tout le volume courant entraînent une forte augmentation de la pression intrapleurale et le développement du phénomène de collapsus expiratoire des petites bronches, entraînant une rétention excessive d'air dans les poumons. Dans le même temps, l'hypoxémie artérielle progresse, la résistance vasculaire pulmonaire augmente, des signes d'insuffisance ventriculaire droite apparaissent et l'index cardiaque diminue fortement. De plus, le syndrome de fatigue des muscles respiratoires se développe en raison du travail énorme mais inefficace des muscles respiratoires. Le prix de l'oxygène de la respiration augmente, une acidose métabolique se développe.
L'hypoxémie artérielle, accompagnant la SA dans près de 100% des cas, est également associée à une inhomogénéité prononcée des zones du parenchyme pulmonaire et à une violation brutale des relations ventilation-perfusion.
L'hypercapnie est également observée dans la SA, mais dans un nombre de cas significativement plus faible, en raison d'une diminution de la ventilation alvéolaire due à l'obstruction bronchique et à la fatigue des muscles respiratoires. L'acidose respiratoire causée par l'hypercapnie s'accompagne souvent d'une alcalose métabolique, mais le développement d'une acidose métabolique est parfois observé en raison d'une hypoxie tissulaire prolongée et d'une augmentation du travail respiratoire.
La SA s'accompagne assez souvent de troubles hémodynamiques des patients. Ceci est associé à une augmentation significative de la pression intrathoracique, particulièrement prononcée à l'expiration, ainsi qu'à un "surgonflage" des poumons, ce qui entraîne une diminution du remplissage diastolique des oreillettes et du cœur droit, un effondrement de la veine cave inférieure. En revanche, il existe un phénomène de protrusion de la cloison interventriculaire dans le cœur gauche et une diminution du remplissage diastolique du ventricule gauche. De plus, avec la SA, il existe une négativité prononcée de la pression intrapleurale pendant l'inspiration, ce qui entraîne une augmentation de la postcharge ventriculaire gauche et le développement du pouls dit "paradoxal" de fluctuations importantes de la valeur de la pression artérielle systolique dans le phases d'inspiration et d'expiration. Une diminution du pouls "paradoxal" indique soit une diminution de l'obstruction bronchique, soit la présence d'une fatigue prononcée des muscles respiratoires et l'impossibilité d'une diminution significative de la pression intrapleurale lors de l'inspiration. L'hyperventilation des poumons, associée à une transpiration accrue, dans la SA entraîne souvent le développement d'une hypovolémie et un épaississement du sang.
IMAGE CLINIQUE
L'évolution clinique de la SA est divisée en trois étapes (Chuchalin, 1985).
Le stade I (compensation relative) est caractérisé par le développement d'une crise d'étouffement non soulageante à long terme. Les patients sont conscients, adéquats. L'essoufflement, la cyanose, la transpiration sont modérément prononcés. Percussion - son pulmonaire avec une nuance de boîte, auscultatoire - respiration affaiblie, réalisée dans tous les services, râles secs épars. A ce stade, une hyperventilation, une hypocapnie et une hypoxémie modérée sont le plus souvent observées. Le VEMS est réduit à 30 % de la valeur due. Le symptôme le plus alarmant est le manque de sécrétion d'expectorations.
Le stade II (décompensation ou "poumon silencieux") se caractérise par un état sévère, une augmentation supplémentaire de l'obstruction bronchique (VEMS,< 20% от должной величины), гипервентиляция сменяется гиповентиляцией, усугубляется гипоксемия, появляются гиперкапния и респираторный ацидоз. Аускультативно выслушиваются зоны "немого" легкого при сохранении дистанционных хрипов. Больной не может сказать ни одной фразы, не переводя дыхания. Грудная клетка эмфизематозно вздута, экскурсия ее почти незаметна. Пульс слабый, до 140 в мин, часто встречаются аритмии, гипотония.
Le stade III (coma hypoxique hypercapnique) se caractérise par une affection extrêmement grave, des troubles cérébraux et neurologiques. La respiration est rare, superficielle. Pouls filiforme, hypotension, collapsus.
Phénomène auscultatoire du "poumon silencieux". Progression de l'acidose respiratoire ou métabolique au cours du traitement. Cependant, chez les patients dans un état grave, les signes cliniques ne sont pas faciles à évaluer en dynamique, par conséquent, à l'heure actuelle, chez les patients atteints de SA, la principale méthode qui permet de le faire facilement et rapidement est la débitmétrie de pointe. L'état extrême du patient est mis en évidence par : la valeur PSV inférieure à 120 l/min, l'impossibilité d'effectuer la manœuvre de débitmétrie de pointe, ou l'absence de dynamique positive à la suite du traitement.
A.G. Chuchalin (1985) distingue deux formes de SA : anaphylactique et métabolique.
La forme anaphylactique de la SA est caractérisée par l'apparition et l'augmentation rapides de l'obstruction bronchique (principalement due à un bronchospasme), des symptômes cliniques de la SA et la progression de l'hypoxémie artérielle. Essentiellement, cette forme de SA est une réaction allergique de type réagine à divers facteurs exogènes. En règle générale, cette forme de SA se développe à la suite de l'utilisation de médicaments auxquels le patient a une sensibilité accrue (antibiotiques, sulfamides, médicaments protéiques, anti-inflammatoires non stéroïdiens, dextrans, enzymes, etc.). De plus, cette forme d'UA se produit lors de la respiration d'air avec une odeur de peinture et de parfum, ainsi qu'avec un traumatisme mental. Beaucoup moins fréquente est la forme métabolique de la SA, qui se caractérise par un développement progressif (sur plusieurs jours) des symptômes cliniques de la SA, une diminution du volume d'activité physique. Le plus souvent, le développement de cette forme de SA est causé par: une utilisation incontrôlée de médicaments, en particulier des glucocorticoïdes, des sédatifs et des antihistaminiques, une exacerbation de l'infection bronchique. Cette forme de SA est caractérisée par une résistance aux bronchospasmolytiques.
Le décès des patients atteints de SA survient à la suite d'une obstruction bronchique progressive, avec l'échec des mesures thérapeutiques, ainsi qu'en raison de troubles hémodynamiques sévères, d'un arrêt cardiaque ou d'un pneumothorax. De plus, les erreurs tactiques des médecins entraînent souvent la mort: prescription tardive et insuffisante de corticoïdes, surdosage en théophylline, glycosides, adrénomimétiques, sédatifs, administration excessive de liquide, bronchospasme accru lors de la bronchoscopie d'assainissement, progression de l'infection bronchopulmonaire dans le contexte de la ventilation mécanique .
Causes de décès dans l'état de mal asthmatique :
1. État asthmatique progressif, ne se prêtant pas à un traitement
2. Thérapie inadéquate : insuffisante, par exemple utilisation insuffisante de stéroïdes
trop massive, par exemple, une surdose d'izadrine, de théophylline
3. L'utilisation de sédatifs ou de drogues
4. Pathologie pulmonaire associée : infection pneumothorax aspiration de vomi
5. Ventilation mécanique inadéquate ou panne du ventilateur
6. Troubles hémodynamiques :
- hypovolémie, choc
- œdème pulmonaire
- hypervolémie
- pression pleurale négative
7. Arrêt cardiaque soudain
TROUBLES LIÉS AU STATUT ASTHMATIQUE
VOLUME VASCULAIRE INTERNE
L'hypovolémie avec une diminution du volume sanguin de 10 % est un trouble fréquent chez les patients souffrant d'un état asthmatique. Ceci s'accompagne d'une augmentation de l'hématocrite et de la concentration de protéines plasmatiques sanguines. La raison de cette diminution apparente du volume plasmatique n'est pas claire. Une diminution du volume intravasculaire peut prédisposer au collapsus circulatoire.
La survenue d'une hypervolémie a également été décrite ; chez certains patients présentant un état asthmatique, la formation d'hormone antidiurétique augmente. Ainsi, une intoxication hydrique et une hypernatrémie peuvent se développer, ce qui doit être pris en compte comme raison possible d'un changement dans l'état du patient.
ŒDÈME PULMONAIRE
Une augmentation de la quantité de liquide dans les poumons entraîne une obstruction supplémentaire des petites bronches en état de mal asthmatique et altère les échanges gazeux. En plus de l'hypervolémie, un œdème pulmonaire peut être induit par la ventilation mécanique. La tendance à fermer les petites bronches augmente la FRU et la traction élastique du tissu pulmonaire. La valeur de la pression intrapleurale est donc plus négative à l'inspiration et ne devient lentement positive à l'expiration que lors d'obstruction bronchique sévère. Dans l'une des études, il a été montré que la pression intrapleurale pendant l'inspiration et l'expiration chez les enfants souffrant d'asthme variait de -7,7 à -25,5 cm de colonne d'eau à un taux de colonne d'eau de 5 cm. Une diminution de la pression intrapleurale réduit également la traction élastique des tissus poumons, ce qui favorise la pénétration du liquide œdémateux dans les poumons.
INSUFFISANCE SURRÉNALE
Tous les patients souffrant d'asthme bronchique qui ont été traités par des hormones dans le passé doivent recevoir systématiquement des corticostéroïdes en cas d'asthme, car la fonction de leurs glandes surrénales peut être considérablement réduite ou totalement absente.
SYSTÈME NERVEUX CENTRAL
Si les symptômes de l'état de mal asthmatique progressent, le patient devient irritable, son esprit est confus. Il peut devenir indifférent, jusqu'à « l'apparition d'un coma. La raison de ceci n'est pas claire. Les facteurs affectant l'état du système nerveux central peuvent être l'hypercapnie et l'hypoxémie, la faiblesse, l'effet des mesures thérapeutiques et, éventuellement, l'intoxication hydrique. L'altération de la conscience du patient est un signe redoutable, reflétant non seulement la gravité de l'état du patient, mais rendant également impossible la thérapie appropriée.
TROUBLES MÉTABOLIQUES
L'acidose métabolique se développe toujours dans l'état asthmatique à la suite d'une augmentation de la teneur en acides lactique et pyruvique dans le sang. Une augmentation de l'intensité de la glycolyse et de la glycolyse anaérobie dans les muscles respiratoires pendant la période d'obstruction extrême des voies respiratoires peut également entraîner une modification de l'équilibre acido-basique du côté acide.
Chez les patients souffrant d'asthme, l'activité de l'aspartate aminotransférase, de la lactate déshydrogénase et de la créatine phosphokinase dans le sérum sanguin est nettement augmentée. La concentration en ions Mq et K + dans le sérum sanguin reste normale. La principale variable dans le sérum sanguin est le 2,3-di-phosphoglycérate, dont la concentration s'élève à 17,5 mol / g Hb "à la limite supérieure de la norme à 16 μmol / g Hb; il s'agit peut-être d'un mécanisme compensatoire pour amélioration de l'apport d'oxygène aux tissus pendant l'état de mal asthmatique.
DIAGNOSTIC DIFFÉRENTIEL
Un patient se plaignant d'essoufflement et de respiration sifflante, associé à une détection objective d'une respiration sifflante expiratoire et d'une inspiration limitée, est diagnostiqué si définitivement avec une crise aiguë d'asthme bronchique que, malheureusement, il oublie d'autres maladies qui pourraient donner des symptômes similaires.
OBSTRUCTION DES VOIES AÉRIENNES SUPÉRIEURES
L'obstruction trachéale intrathoracique provoque principalement une respiration sifflante expiratoire, qui ne se distingue pas de la respiration sifflante dans le bronchospasme. Une telle obstruction trachéale peut être due à une sténose trachéale, à une artère pulmonaire aberrante ou à un corps étranger. Le diagnostic est aidé par la clarification de l'apparition de la maladie, mais il ne peut être confirmé que par bronchoscopie.
Bien que l'obstruction extrathoracique de la trachée ou du larynx provoque principalement des difficultés respiratoires, elles peuvent simuler l'asthme bronchique. Nous avons observé une obstruction causée par une grosse pilule insérée dans la bouche d'un patient âgé, considérée comme un « bronchospasme » et traitée par une perfusion intraveineuse d'aminophylline.
EMBOLIE PULMONAIRE
Un essoufflement et une respiration sifflante expiratoire peuvent survenir en cas d'embolie pulmonaire. Le diagnostic différentiel nécessite généralement une angiographie pulmonaire. L'analyse montrera les changements dans les deux processus.
ŒDÈME PULMONAIRE
L'œdème pulmonaire s'accompagne souvent d'un gonflement des espaces péribronchiques et de l'apparition d'une respiration sifflante expiratoire. L'œdème peut être associé à une augmentation de la pression ventriculaire gauche et peut nécessiter un cathétérisme de l'artère pulmonaire avec un cathéter à ballonnet flottant pour le diagnostic. L'œdème pulmonaire à pression normale est difficile à diagnostiquer, mais il peut être suspecté à l'examen clinique.
INFECTION PULMONAIRE
La bronchite aiguë ou la bronchiolite peuvent simuler l'asthme bronchique. L'examen des crachats avec coloration de Gram peut aider à établir un diagnostic. L'étude des leucocytes est inutile, une leucocytose est souvent observée en l'absence d'infection pulmonaire.
Rupture pulmonaire
L'air dans l'interstitium des poumons ou dans le médiastin peut comprimer les voies respiratoires, simulant un spasme des muscles lisses des bronches. Une respiration sifflante expiratoire peut également survenir en cas de pneumothorax.
ASPIRATION GASTRIQUE
L'essoufflement et la respiration sifflante expiratoire peuvent être causés par l'aspiration du contenu gastrique. Dans le même temps, les changements caractéristiques et le diagnostic ne sont pas visibles sur la radiographie pulmonaire; mis par la méthode d'élimination.
MEDICAMENTS
Les médicaments peuvent provoquer un tableau clinique identique au tableau clinique de l'asthme bronchique, en raison d'une hypersensibilité à ceux-ci ou directement.
Principes et méthodes de traitement de la SA
Le traitement de la SA est généralement médicamenteux. En cas d'échec du traitement conservateur, la ventilation mécanique est la méthode de choix. La gravité et la rapidité du développement des symptômes cliniques de la SA dictent la nécessité de fournir une assistance aux patients dans les unités de soins intensifs ou les unités de soins intensifs.
Les grands principes du traitement de la SA sont : un puissant traitement bronchodilatateur, l'instauration immédiate de l'administration de glucocorticoïdes, un traitement rapide, la facilité des procédures pour le patient, la correction des troubles secondaires des échanges gazeux, l'état acido-basique, l'hémodynamique, etc.
Les glucocorticoïdes sont le médicament numéro un de la SA. Ils sont capables d'éliminer le blocage fonctionnel des récepteurs bêta-adrénergiques. L'introduction de ces médicaments doit être commencée immédiatement, cependant, la thérapie par glucocorticoïdes ne doit pas être considérée comme une monothérapie, car l'effet de ces médicaments lorsqu'ils sont administrés par voie intraveineuse ne doit pas être attendu avant 1 à 2 heures plus tard. La posologie habituelle d'hydrocortisone pour la SA est de 600-1200 mg/jour.
Le traitement par reg os glucocorticoïdes est réalisé à raison de 0,5 mg/kg de prednisolone, suivi d'une diminution progressive de la dose. Si des médicaments hormonaux sont injectés à une dose suffisante, vous restaurez l'effet d'arrêt des sympathomimétiques.
Dans le cas d'une affection extrêmement grave des patients causée par une obstruction bronchique généralisée en augmentation rapide, avec une faible efficacité des mesures thérapeutiques, un traitement par impulsions avec de la méthylprednisolone (1000 mg) est indiqué. L'expérience de l'utilisation de la thérapie pulsée dans la SA témoigne sans ambiguïté de la grande efficacité de cette méthode de traitement de cette catégorie de patients.
La théophylline reste un médicament souvent utilisé dans la SA.La dose initiale d'aminophylline est de 5-6 mg/kg, à l'avenir, il est conseillé de la réduire à 0,6-1,0 mg/kg. La dose quotidienne maximale d'aminophylline est de 2 g. L'utilisation de préparations de théophylline nécessite une surveillance constante de l'activité cardiaque en raison de la tachycardie et des arythmies assez fréquentes. Des décès associés à l'utilisation de préparations de théophylline dans la SA ont été décrits.
Lorsque la sensibilité des récepteurs bêta-adrénergiques est restaurée, il est possible de connecter les agonistes bêta-2-adrénergiques à la thérapie. Ils sont généralement administrés par inhalation. L'utilisation d'agonistes bêta 2-adrénergiques sous forme d'inhalation d'aérosols obtenus à l'aide de nébuliseurs (nébuliseurs) de diverses modifications, capables de générer des aérosols d'une granulométrie de 0,5 à 5 microns, a de grandes perspectives. Dans ce cas, la prolongation de l'inhalation est obtenue, la nécessité d'une synchronisation obligatoire de l'inhalation et de la pulvérisation d'aérosols est éliminée, les voies respiratoires des patients sont humidifiées et, par conséquent, l'obtention d'une bronchodilatation efficace est notée.
Avec la forme anaphylactique de la SA, l'administration d'une solution d'adrénaline est indiquée. Il est généralement administré par voie sous-cutanée. Certains chercheurs préfèrent injecter une solution d'adrénaline par voie intraveineuse avec AS à raison de 0,1 mg/kg/min. Cependant, cette thérapie s'accompagne de nombreux effets secondaires et est réalisée en cas d'échec du traitement ou de collapsus.
En présence de signes d'infection bronchique et d'absence de réactions allergiques, une antibiothérapie est prescrite.
L'oxygénothérapie est généralement indiquée dans la SA en cas d'hypoxémie artérielle (PaO2 inférieure à 60 mm Hg). Lorsqu'elle est réalisée avec une teneur en oxygène inférieure à 30%, en règle générale, aucune augmentation de l'hypercapnie n'est observée. L'oxygénothérapie est réalisée à l'aide d'une canule nasale ou d'un masque Venturi à un débit de 1 à 5 L/min. La gazométrie du sang artériel est surveillée 20 à 30 minutes après le début de l'oxygénothérapie, ce qui est considéré comme efficace s'il est possible de maintenir un niveau de PaO2 supérieur à 80 mm Hg. De l'art. et SatO2, plus de 90 %.
La ventilation pulmonaire assistée (IVL) est indiquée en cas de persistance de l'hypoxémie artérielle, de progression de l'hypercapnie artérielle chez les patients sous oxygénothérapie, ainsi que de fatigue sévère des muscles respiratoires. La tâche principale de l'IVL est de gagner du temps pour une thérapie médicamenteuse massive visant à éliminer l'obstruction bronchique, sans supprimer la respiration spontanée du patient. L'IVL est réalisée à la fois en mode de déclenchement et en mode d'adaptation à l'aide de masques faciaux ou nasaux. Afin d'éviter le collapsus expiratoire des petites bronches, ainsi que de réduire la consommation d'énergie excessive de la respiration chez les patients présentant un niveau élevé de pression positive spontanée à la fin de l'expiration, il est recommandé d'utiliser une pression positive externe pendant l'expiration dans les 5-9 cm d'eau. De l'art. sous le contrôle des paramètres hémodynamiques.
Les indications de transfert du patient vers une ventilation pulmonaire artificielle (VPA) avec SA sont :
Obligatoire:
1. Violation de la conscience ;
2. Arrêt cardiaque ;
3. Arythmies cardiaques mortelles.
Optionnel:
4. Acidose progressive (pH< 7,2);
5. Hypercapnie progressive ;
6. Hypoxémie réfractaire ;
7. Dépression respiratoire;
8. Excitation ;
9. Fatigue sévère des muscles respiratoires.
Le principal problème qui se pose lors de la ventilation mécanique chez les patients atteints de SA est la prévention d'une augmentation du "surgonflage" des poumons. À cette fin, il est recommandé de respecter les tactiques suivantes: effectuer une ventilation mécanique, empêchant le développement d'une pression élevée dans les voies respiratoires (moins de 35 cm d'eau), la fréquence de ventilation ne doit pas dépasser 6-10 par minute, marée volume - 6-8 ml / kg. Cela conduit inévitablement à une diminution de la ventilation alvéolaire minute et à une augmentation de l'hypercapnie (hypercapnie permissive ou admissible). Un niveau adéquat de PaO2 est maintenu en augmentant la teneur en oxygène du mélange inhalé à plus de 60 % ; une diminution du pH du sang artériel en dessous de 7,2 est corrigée par l'administration de bicarbonate de sodium. La stratégie d'hypoventilation contrôlée permet d'assurer un niveau adéquat d'oxygénation du sang artériel, tout en réduisant significativement le risque de barotraumatisme pulmonaire et l'incidence des complications hémodynamiques de la ventilation mécanique, qui sont souvent retrouvées chez les patients atteints de SA.
L'analyse des causes et des schémas de développement de la SA suggère que son évolution dépend en grande partie du comportement du médecin.
Un diagnostic précoce et un traitement rationnel rapide permettent une prévention fiable de la progression de la SA, aux stades ultérieurs desquels l'efficacité du traitement devient douteux.
Pour citer : Nenasheva N.M. Exacerbation de l'asthme bronchique : traitement et prévention // BC. 2013. N°29. S. 1490
L'asthme bronchique (AB) est une maladie caractérisée par une évolution variable. Les exacerbations de l'asthme ne sont pas rares dans la vie des patients atteints de cette maladie.
Définition du concept
et la gravité de l'exacerbation de l'asthme
Selon la définition du GINA, l'exacerbation de l'asthme (asthme aigu) correspond à des épisodes de manifestations asthmatiques prononcées : essoufflement croissant, toux, respiration sifflante, congestion thoracique ou toute combinaison de ces symptômes. Une détresse respiratoire et une insuffisance respiratoire aiguë peuvent se développer. L'exacerbation BA est caractérisée par une diminution du débit volumétrique d'air expiré, qui peut être déterminée en examinant la fonction pulmonaire pour diminuer le débit expiratoire de pointe (PSV) ou le volume expiratoire forcé en 1 s (FEV1). Dans un document conjoint de l'European Respiratory Society (ERS) et de l'American Thoracic Society (ATS), consacré à la définition du contrôle et des exacerbations de l'asthme dans les essais cliniques et en pratique clinique réelle, il est proposé de distinguer les exacerbations sévères et modérées de asthme.
L'exacerbation sévère est définie comme un événement nécessitant une action immédiate d'un médecin par rapport à un patient afin de prévenir le développement d'une insuffisance respiratoire aiguë et la mort. L'exacerbation sévère implique l'utilisation de glucocorticoïdes systémiques (GCS) (formes orales ou parentérales), ou une augmentation de la dose d'entretien de GCS pendant au moins 3 jours, et/ou une hospitalisation, ou la recherche d'une aide d'urgence pour la nomination d'un GCS systémique.
L'exacerbation modérée de l'asthme est définie comme un événement qui provoque de l'anxiété chez le patient et nécessite un changement de traitement, mais n'est pas grave. Avec une exacerbation modérée, il y a une augmentation des symptômes, incl. nocturne, fonction pulmonaire diminuée, besoin accru d'agonistes β2 à courte durée d'action. Ces changements doivent durer au moins 2 jours ou plus, mais ne doivent pas être prononcés au point de nécessiter la nomination de corticoïdes systémiques et/ou une hospitalisation.
Il n'est pas recommandé d'utiliser le terme « légère aggravation », car il est difficile de le séparer de l'état de perte temporaire de contrôle AD, qui est un reflet courant de la variabilité de l'évolution AD. Je dois dire que ces recommandations s'appliquent principalement aux essais cliniques. En pratique clinique normale, la sévérité d'une exacerbation est déterminée par la sévérité des symptômes (dyspnée), les données de l'examen physique (fréquence respiratoire (RR), pouls, tableau auscultatoire, présence d'un pouls paradoxal), les résultats de la mesure du PSV, tension d'oxygène (PaO2) et/ou tension de dioxyde de carbone dans le sang artériel (PaCO2), degré de saturation de l'hémoglobine du sang artériel en oxygène, saturation en oxygène (SpO2) (tableau 1). Vous trouverez ci-dessous les critères d'exacerbations sévères et potentiellement mortelles de l'asthme, selon l'Accord britannique sur le traitement de l'asthme.
Critères d'exacerbation sévère de l'asthme :
... PSV 33-50% du meilleur ou du dû ;
... RR ≥25 / min;
... FC (fréquence cardiaque) ≥110 / min;
... discours interrompu.
Critères d'exacerbation mettant en jeu le pronostic vital chez un patient souffrant d'asthme sévère :
... PSV<33% от лучшего или должного;
... SpO2<92%;
... PaO2<8 kPa;
... Taux de PaCO2 (4,6-6,0 kPa);
... Poumon muet;
... cyanose;
... faiblesse des muscles respiratoires;
... arythmie;
... épuisement, altération de la conscience.
Le taux de développement d'une exacerbation de l'asthme peut varier considérablement selon les patients - de plusieurs minutes ou heures à 2 semaines, ainsi que le temps nécessaire pour résoudre l'exacerbation - de 5 à 14 jours. Des exacerbations de l'asthme peuvent se développer chez n'importe quel patient, quelle que soit la gravité de la maladie, mais elles sont considérées comme une manifestation clinique fréquente chez les patients souffrant d'asthme difficile à contrôler. Au cours d'un programme de recherche pour l'étude de l'asthme sévère aux États-Unis, il a été montré que les patients souffrant d'asthme sévère sont significativement plus susceptibles de développer des exacerbations nécessitant une hospitalisation, incl. dans l'unité de soins intensifs, ainsi que la nomination d'une ventilation mécanique des poumons, par rapport aux patients souffrant d'asthme léger et modéré (Fig. 1). La fréquence annuelle des exacerbations sévères de l'asthme chez les patients souffrant d'asthme léger, modéré et sévère était de 5, 13, 54 %, et des exacerbations proches du décès - 4, 6, 23 %, respectivement. Dans le même temps, sur le nombre total d'hospitalisations pour exacerbation de l'asthme, 30 à 40 % concernent des patients atteints d'une forme bénigne de la maladie.
Les infections virales respiratoires se classent au premier rang des causes d'exacerbations de l'asthme. On sait que 85 % des exacerbations de BA chez les enfants et 60 % chez les adultes sont causées par des virus respiratoires, principalement des rhinovirus. De plus, l'exposition à un allergène, notamment un contact massif, provoque également une exacerbation de l'asthme, et la combinaison de ces deux déclencheurs multiplie plusieurs fois le risque d'exacerbation (OR 8,4 ; IC 95%, 2,1-32,8).
Traitement de l'exacerbation BA chez l'adulte
Les patients présentant un risque élevé de développer des exacerbations sévères et fatales de l'asthme doivent immédiatement consulter un médecin dès les premiers signes d'une exacerbation en développement. Ce groupe comprend les patients suivants :
- ayant des antécédents d'exacerbations d'asthme mettant en jeu le pronostic vital, nécessitant une intubation et une ventilation artificielle des poumons ;
- hospitalisé ou sollicitant une aide d'urgence pour une exacerbation de l'asthme au cours de la dernière année ;
- recevoir en permanence ou récemment annulé des corticoïdes oraux ;
- ne pas recevoir de corticoïdes inhalés (CSI) ;
- avec un besoin élevé en -agonistes à courte durée d'action (CDBA) (> 1 inhalateur/mois) ;
- avec une maladie mentale ou des problèmes psychosociaux (utilisation de sédatifs et de stupéfiants) ;
- avec une faible adhérence au traitement et ne remplissant pas la prescription du médecin ;
- les fumeurs;
- sensibilisé à Alternaria spp.
La sévérité de l'exacerbation détermine la stratégie et la portée du traitement. Les patients présentant des exacerbations légères à modérées peuvent être traités en ambulatoire. Les patients présentant des exacerbations sévères doivent être traités dans un hôpital en soins intensifs. Le tableau 2 présente les principales possibilités thérapeutiques et médicaments pour le traitement des exacerbations de l'asthme, selon les recommandations du GINA et de la British Thoracic Society.
Des doses élevées d'agonistes β2 inhalés sont le traitement de première intention de l'exacerbation de l'asthme et doivent être prescrites le plus tôt possible ! (Niveau de preuve A.)
Avec une exacerbation de l'asthme, dans chaque cas, une révision du traitement anti-asthmatique de base du patient et une analyse des causes de l'exacerbation développée sont nécessaires.
Indications d'orientation du patient vers le service de réanimation et de prise en charge d'urgence :
1) le besoin d'un support de ventilation ;
2) avec exacerbation sévère ou potentiellement mortelle et absence de réponse au traitement en cours, se manifestant par :
- détérioration du PSV ;
- persistance ou aggravation de l'hypoxie ;
- hypercapnie ;
- une étude des gaz du sang montrant le pH ou ↓ H + ;
- épuisement, respiration faible ;
- somnolence, confusion, altération de la conscience ;
- arrêt respiratoire.
Le traitement par CSI à fortes doses, utilisé avec un nébuliseur, notamment avec le budésonide 2 ou 4 mg/jour pour 4 doses, a été aussi efficace qu'un traitement par corticoïdes oraux (prednisone 40 mg/jour). Cette stratégie de traitement de l'exacerbation a été étudiée principalement chez les enfants, cependant, dans une étude chez l'adulte, elle s'est également avérée efficace pour soulager les exacerbations de l'asthme de sévérité variable. L'utilisation d'une suspension de budésonide (2 mg 2 fois/jour) par nébuliseur pendant 5 jours a été comparée au traitement traditionnel de l'exacerbation de l'asthme avec la prednisolone 15 mg 2 fois/jour chez des patients adultes. Les résultats ont montré que les deux stratégies de traitement de l'exacerbation de l'asthme étaient efficaces pour soulager les symptômes de l'exacerbation et restaurer la fonction pulmonaire. Cependant, des études multicentriques complémentaires sont sans doute nécessaires pour confirmer l'efficacité de la stratégie d'utilisation de fortes doses de CSI dans le traitement des exacerbations de l'asthme.
Prévention des exacerbations de l'asthme
Les objectifs du traitement de la MA sont d'atteindre et de maintenir le contrôle de la maladie, déterminé par le minimum (pas plus de 2 cas par semaine) de symptômes diurnes et le besoin de médicaments pour les soulager, l'absence de symptômes nocturnes et la limitation de l'activité du patient. , ainsi qu'une fonction pulmonaire normale. La réduction du risque d'exacerbations, la réduction de la fonction pulmonaire et le développement d'effets secondaires indésirables des médicaments (Fig. 2) sont parmi les éléments importants du contrôle global de l'asthme (Fig. 2).
Les ICS sont le groupe de médicaments pharmacologiques le plus efficace pour contrôler et prévenir les exacerbations de BA chez les enfants et les adultes. Ils sont particulièrement efficaces dans l'inflammation éosinophile, et la titration de la dose de CSI en fonction du taux d'éosinophiles dans l'expectoration induite conduit à un contrôle stable et à une diminution du nombre d'exacerbations de l'asthme par rapport à la stratégie traditionnelle basée sur la surveillance des symptômes et des poumons. fonction. Cependant, la monothérapie avec les CSI n'est pas efficace chez tous les patients pour atteindre le contrôle de la MA, car dans la pratique clinique de routine, de nombreuses raisons expliquent une réponse réduite aux CSI (tableau 3).
Comme le montre le tableau 3, dans la plupart des cas, les 2-agonistes à longue durée d'action (BALA) aident à optimiser la réponse aux CSI. ICS et LABA présentent un effet complémentaire. Les ICS augmentent l'expression du gène des récepteurs 2-adrénergiques, activant ainsi la synthèse de ces récepteurs et augmentant leur expression sur la membrane cellulaire ; de plus, les ICS empêchent la désensibilisation des récepteurs β2-adrénergiques. Simultanément, les LABA activent les récepteurs GCS inactifs, les rendant plus sensibles à l'activation dépendante des stéroïdes.
L'efficacité clinique des médicaments combinés ICS / LABA se manifeste par l'obtention d'un contrôle chez un plus grand nombre de patients et une diminution significative du nombre d'exacerbations sévères de l'asthme, ce qui a été noté pour la première fois dans l'étude FACET. Il a été montré que l'ajout de formotérol à des doses faibles et élevées de budésonide entraîne une diminution significative du nombre d'exacerbations de l'asthme chez un patient par an (Fig. 3).
Cet effet a été démontré dans de nombreuses études qui ont examiné diverses combinaisons d'ICS et de BALA. La synergie de l'action des CSI et du BALA se manifeste par une diminution de l'inflammation éosinophile, la prévention du bronchospasme et l'inhibition du remodelage de la paroi bronchique, ce qui conduit in fine à un contrôle efficace de l'asthme et à une diminution du risque d'exacerbations.
Pour le médicament combiné BUD / FOR (Symbicort®), la stratégie de traitement avec un seul inhalateur est utilisée, dont l'essence est l'utilisation du médicament à la fois pour le contrôle à long terme en tant que thérapie de base et pour le soulagement de l'émergence symptômes d'asthme, ce qui est possible en raison de l'apparition rapide de l'effet bronchodilatateur du formotérol (pendant 1 à 3 minutes). De plus, le formotérol se caractérise par un effet bronchodilatateur dose-dépendant, contrairement au salmétérol. La justification de la stratégie d'un seul inhalateur, en plus des effets du formotérol, est l'effet anti-inflammatoire supplémentaire des CSI inhalés simultanément avec le formotérol pour soulager les symptômes, qui, comme prévu, se manifeste par un effet clinique supplémentaire - une diminution dans l'incidence des exacerbations de l'asthme.
Cette stratégie a été étudiée dans plusieurs grands essais cliniques randomisés comparatifs, qui ont démontré que l'utilisation de EUD/FOR dans un seul mode inhalateur réduit l'incidence des exacerbations sévères de l'asthme nécessitant une hospitalisation et l'administration de corticostéroïdes systémiques, réduit les symptômes de l'asthme et améliore la fonction pulmonaire. par rapport à un traitement quadruple dose de budésonide ou utilisation de BUD/FOR pour le traitement d'entretien et d'ACAA pour le soulagement des symptômes. Cet effet a été observé chez des patients souffrant d'asthme sévère et modéré, non contrôlés par des doses moyennes de CSI ou leur association avec le BALA, qui avaient également des antécédents d'exacerbations sévères de l'asthme.
À l'heure actuelle, le mécanisme de l'action préventive de la stratégie de l'inhalateur unique par rapport aux exacerbations de l'asthme n'est pas entièrement compris. Apparemment, une augmentation de la dose de CSI simultanément avec des inhalations supplémentaires de BALA pendant la période des premiers signes d'exacerbation de l'asthme (l'augmentation des symptômes de l'asthme dure généralement de 5 à 7 jours) peut empêcher une exacerbation supplémentaire, à condition que le patient les ressente et les évalue de manière adéquate. symptômes. Une analyse rétrospective de 5 grands essais cliniques randomisés (> 12 000 patients) de l'efficacité comparative de l'EUD/FOR, utilisé en mode inhalateur unique, et de divers schémas thérapeutiques traditionnels a montré les avantages de cette stratégie à tous les stades du traitement (selon GINA) en termes de réduction du nombre d'exacerbations sévères de l'asthme (fig. 4).
Il a déjà été mentionné ci-dessus que la cause la plus fréquente d'exacerbations de BA chez les adultes et les enfants est les infections respiratoires virales, qui entraînent souvent une perte de contrôle et le développement d'exacerbations même chez les patients dont l'asthme est bien contrôlé. Une diminution du risque de leur développement a été montrée dans le contexte de la thérapie ICS / LABA par rapport à la monothérapie ICS, ce qui indique une fois de plus un effet anti-inflammatoire prononcé des médicaments combinés. L'évolution variable de la MA nécessite souvent une réponse rapide à l'apparition des symptômes d'un début d'exacerbation de la maladie, et à cet égard, l'utilisation des CSI « à la demande » (lorsque les symptômes apparaissent) après ou simultanément avec un CBAA ou un LABA (formotérol ) est une stratégie prometteuse.
Une vaste étude analytique rétrospective a étudié la relation entre les infections respiratoires (rhumes) et les exacerbations sévères de l'asthme chez 12 507 patients qui ont participé à 5 grands essais cliniques randomisés en double aveugle, au cours desquels la stratégie d'utilisation de FUD/FORA en mode inhalateur unique a été évalué en comparaison avec d'autres schémas thérapeutiques (ICS/BALA à doses fixes identiques ou supérieures + CBAA ou formotérol selon les besoins). Les exacerbations sévères de l'asthme ont été considérées comme des exacerbations nécessitant la nomination d'un GCS systémique pendant 3 jours ou plus et/ou une hospitalisation, ou la recherche d'une aide d'urgence. Une exacerbation de l'asthme associée à une infection respiratoire aiguë (IRA) a été considérée comme une exacerbation qui s'est développée dans les 14 jours suivant l'apparition d'un rhume.
Comme prévu, les résultats de l'analyse ont montré que l'incidence des IRA ne différait pas entre les patients recevant différents schémas thérapeutiques anti-asthmatiques avec CSI/BALA (20-22% des patients par année de suivi). L'augmentation de la fréquence des IRA a été constatée en période automne-hiver, la durée moyenne des IRA était de 7 jours. La fréquence des exacerbations sévères de l'asthme était significativement plus faible chez les patients ayant reçu BUD/FOR en mode inhalateur unique, par rapport aux autres stratégies + ACAA (9-13 et 12-22%, respectivement). Au cours de la période d'IRA, l'avantage de BUD/FOR dans le schéma d'inhalation unique a été noté en termes de réduction du risque d'exacerbations de BA de 36 % par rapport au schéma de traitement d'entretien avec des doses fixes de CSI/BALA + CBAA selon les besoins (Fig. 5 ). La différence maximale dans la fréquence des exacerbations sévères de l'asthme associées aux IRA a été trouvée entre les régimes d'un seul inhalateur BUD/FOR (réduction des exacerbations de 52%) et des doses fixes équivalentes de CSI/BALA + CBAA, ce qui peut indiquer l'importance d'une augmentation opportune du traitement anti-inflammatoire anti-asthmatique à l'aide de doses supplémentaires de CSI en association avec le BALA en relation avec la prévention de l'exacerbation de l'asthme.
Conclusion
Des exacerbations de l'asthme peuvent se développer chez n'importe quel patient, quelle que soit la gravité de la maladie, mais le plus souvent, les patients souffrant d'asthme sévère ou difficile à contrôler en souffrent. La prévention des exacerbations de l'asthme est une composante importante d'un contrôle complet et stable de la maladie. Les CSI constituent le groupe de médicaments pharmacologiques le plus efficace pour contrôler et prévenir les exacerbations de BA chez les enfants et les adultes. L'association des CSI et du BALA est plus efficace lorsqu'elle est utilisée régulièrement chez les patients présentant des symptômes d'asthme non contrôlés par les CSI en monothérapie. L'utilisation de BUD / FOR dans un seul mode inhalateur s'est avérée être une stratégie efficace pour réduire la fréquence des exacerbations sévères de l'asthme, incl. à la suite de l'ARI.





Littérature
1. GINA, www.ginasthmaorg.org.
2. Reddel H.K., Taylor D.R., Bateman E.D. et al. Une déclaration officielle de l'American Thoracic Society / European Respiratory Society : contrôle de l'asthme et exacerbations : normalisation des critères d'évaluation pour les essais cliniques sur l'asthme et la pratique clinique // Am J Respir Crit Care Med. 2009. Vol. 180. P. 59-99.
3. Ligne directrice britannique sur la gestion de l'asthme. Une directive clinique nationale. www.brit-thoracic.org.uk.
4. Moore W.C., Bleecker E.R., Curran-Everett D. et al. Caractérisation du phénotype de l'asthme sévère par le programme de recherche sur l'asthme sévère du National Heart, Lung, and Blood Institute // J Allergy Clin Immunol. 2007. Vol. 119. P. 405-413.
5. Pendergraft T.B., Stanford R.H., Beasley R. et al. Taux et caractéristiques des admissions et des intubations en unité de soins intensifs parmi les hospitalisations liées à l'asthme // Ann Allergy Asthma Immunol. 2004. Vol. 93. P. 29-35.
6. Johnston S.L., Pattemore P.K., Sanderson G. et al. La relation entre les infections des voies respiratoires supérieures et les hospitalisations pour asthme : une analyse de tendance temporelle // Am J Respir Crit Care Med. 1996. Vol. 154. P. 654-660.
7. Johnston S.L., Pattemore P.K., Sanderson G. et al. Étude communautaire du rôle des infections virales dans les exacerbations de l'asthme chez les enfants de 9 à 11 ans // BMJ. 1995. Vol. 310. P. 1225-1229.
8. Green R.M., Custovic A., Sanderson G. et al. Synergie entre allergènes et virus et risque d'hospitalisation pour asthme : étude cas-témoins // BMJ. 2002. Vol. 324. P.763.
9. FitzGerald J.M., Shragge D., Haddon J. et al. Un essai contrôlé randomisé de budésonide inhalé à haute dose par rapport à la prednisolone orale chez des patients sortis du service d'urgence à la suite d'une exacerbation aiguë de l'asthme // Can Respir J. 2000. Vol. 7.P.61-67.
10. Volovitz B. Le budésonide inhalé dans la gestion des aggravations et des exacerbations aiguës de l'asthme: une revue des preuves // Respir Med. 2007. Vol. 101 (4). R. 685-695.
11. Chian C.F., Tsai C.L., Wu C.P. et al. Une cure de cinq jours de budésonide en suspension pour inhalation est aussi efficace que la prednisolone orale dans le traitement des exacerbations d'asthme aiguës légères à sévères chez l'adulte // Pulm Pharmacol Ther. 2011. Vol. 24 (2). R. 256-260.
12. Bateman E.D., Reddel H.K., Friksson G. et al. Contrôle global de l'asthme : la relation entre le contrôle actuel et le risque futur // The Journal of Allergy and Clinical Immunology. 2010. Vol. 125 (3). R. 600-608.
13. Green R. H., Brightling C. E., McKenna S. et al. Exacerbations de l'asthme et nombre d'éosinophiles dans les expectorations : un essai contrôlé randomisé // Lancet. 2002. Vol. 360.R.1715-1721.
14. Pauwels R.A., Lofdahl C.G., Postma D.S., Tattersfield A.E., O'Byrne P., Barnes P.J. et al. Effet du formotérol et du budésonide inhalés sur les exacerbations de l'asthme. Groupe d'étude international sur le formotérol et les corticostéroïdes établissant la thérapie (FACET) // N Engl J Med. 1997. Vol. 337. P. 1405-1411.
15. Bateman E.D., Boushey H.A., Bousquet J. et al. Le contrôle de l'asthme défini par les lignes directrices peut-il être atteint? L'étude Gaining Optimal Asthma Control // Am J Respir Crit Care Med. 2004. Vol. 170. P. 836-844.
16. Stanford R.H., Fuhlbrigge A., Riedel A., Rey G.G., Stempel D.A. Une étude observationnelle d'une combinaison à dose fixe de propionate de fluticasone / salmétérol ou de propionate de fluticasone seul sur les résultats liés à l'asthme // Curr Med Res Opin. 2008. Vol. 24. P. 3141-3148.
17. Papi A., Paggiaro P. L., Nicolini G. et al. Traitement combiné béclométhasone/formotérol versus budésonide/formotérol dans l'asthme // Eur Respir J. 2007. Vol. 29. P. 682-689.
18. O'Byrne P.M., Bisgaard H., Godard P.P. et al. Thérapie combinée budésonide / formotérol comme médicament d'entretien et de soulagement dans l'asthme // Am J Respir Crit Care Med. 2005. Vol. 171.P.129-136.
19. Rabe K.F., Atienza T., Magyar P. et al. Effet du budésonide en association avec le formotérol pour le traitement de soulagement dans les exacerbations de l'asthme : une étude randomisée contrôlée en double aveugle // Lancet. 2006. Vol. 368. P. 744-753.
20. Bousquet J., Boulet L.P., Peters M.J. et al. Budésonide/formotérol pour l'entretien et le soulagement de l'asthme non contrôlé vs. salmétérol à haute dose / fluticasone // Respir Med. 2007. Vol. 101. P. 2437-2446.
21. Bateman E.D., Harrison T.W., Quirce S. et al. Contrôle global de l'asthme obtenu avec le budésonide/formotérol d'entretien et un traitement de soulagement pour les patients suivant différentes étapes de traitement // Respir Res. 2011. Vol. 12, p. 38.
22. Prazma C.M., Kral K.M., Gul N. et al. Médicaments de contrôle et leurs effets sur les exacerbations de l'asthme temporellement associées aux infections des voies respiratoires supérieures // Respir Med. 2010. Vol. 104. P. 780-787.
23. Papi A., Canonica G., Maestrelli P. et al. Utilisation de secours de la béclométhasone et de l'albutérol dans un seul inhalateur pour l'asthme léger // N Engl J Med. 2007. Vol. 356. R. 2040-2052.
24. Calhoun W.J., Ameredes B.T., King T.S. et al. Comparaison des stratégies basées sur les médecins, les biomarqueurs et les symptômes pour l'ajustement de la corticothérapie inhalée chez les adultes asthmatiques : l'essai contrôlé randomisé BASALT // JAMA. 2012. Vol. 308 (10). R. 987-997.
25. Papi A., Corradi M., Pigeon-Francisco C. et al. Béclométasone-formotérol comme traitement d'entretien et de soulagement chez les patients asthmatiques : un essai contrôlé randomisé en double aveugle // Lancet Respir Med. 2013. Vol. 1.R.23-31.
26. Reddel H., Jenkins C., Quirce S. et al. Effet de différents traitements de l'asthme sur le risque d'exacerbations liées au froid // Eur Respir J. 2011. Vol. 38. P. 584-593.
L'exacerbation de l'asthme bronchique correspond à des épisodes d'augmentation progressive de l'essoufflement, de la toux, de la respiration sifflante, de l'essoufflement, de la pression thoracique ou d'une combinaison de ces symptômes (GINA, 2006). Causes d'exacerbation : ARVI, prise d'anti-inflammatoires non stéroïdiens, antalgiques, inhibiteurs de l'ECA, inhalation de fumée de tabac et de polluants, contact avec un allergène, stress, reflux gastro-œsophagien, traitement inadéquat de l'asthme bronchique. Avant de commencer le traitement, il est nécessaire d'évaluer la gravité de l'exacerbation.
Tableau 7. Gravité de l'exacerbation de l'asthme bronchique
|
L'arrêt de la respiration est inévitable |
||||
|
en marchant peut mentir |
en parlant préfère s'asseoir |
assis penché en avant | ||
|
Discours (conversation) |
suggestions | |||
|
Niveau d'éveil |
peut être excité |
généralement suscité |
généralement suscité |
conscience léthargique ou confuse |
|
augmenté |
augmenté |
souvent > 30 bpm | ||
|
participation des muscles accessoires à la respiration |
ont généralement |
mouvement paradoxal de la poitrine et de la paroi abdominale |
||
|
respiration sifflante |
modéré, souvent seulement à l'expiration |
généralement bruyant |
absent |
|
|
pouls (par minute) |
bradycardie |
|||
|
pouls paradoxal |
absent |
il peut y avoir 10-25 mm Hg. |
souvent disponible > 25 mmHg |
manque de muscles respiratoires pendant la fatigue |
|
PSV après administration d'un bronchodilatateur |
environ 60-80% |
< 60 % от должных величин | ||
|
PaO2 (en respirant de l'air) |
<45 мм рт.ст. |
60 mm de mercure <45 мм рт.ст. |
< 60 мм рт.ст > 45 mmHg | |
|
SatO2% (en respirant de l'air) |
Un exemple de diagnostic.
De baseDS: Asthme bronchique, endogène, incontrôlé, exacerbation sévère, DNIIIst.
Figure 10. Traitement des patients présentant une exacerbation de l'asthme bronchique (GINA, 2006).
Exacerbation de la maladie pulmonaire obstructive chronique
Lors de l'évaluation des symptômes cliniques, une attention particulière est accordée à la participation des muscles auxiliaires à l'acte respiratoire, aux mouvements paradoxaux de la poitrine, à l'apparition ou à l'aggravation d'une cyanose centrale, à l'apparition d'un œdème périphérique, à l'état hémodynamique (instabilité hémodynamique). Évaluation de la fonction respiratoire - diminution du PSV inférieure à 100 litres par minute ou du VEMS inférieur à 1 litre, pO 2<60 мм рт.ст., сатурация О 2 менее при дыхании комнатным воздухом говорит о тяжелом обострении ХОБЛ. ОФВ 1 на уровне 0,75 л или РаО 2 /FiО 2 32 кПа (240 мм рт. ст.) может хорошо переноситься лицами с тяжелой ХОБЛ, которые живут с этими показателями в стабильном состоянии, в то время как подобные параметры для тех, у кого в стабильном состоянии имеются чуть большие значения, например ОФВ 1 ~0,9 л или РаО 2 /FiО 2 ~ 38 кПа (282 мм рт. ст.), могут указывать на тяжелое обострение.
Gaz du sang artériel. Dans un hôpital avec une exacerbation sévère de la BPCO, la détermination du niveau des gaz du sang artériel est obligatoire. Si, en respirant l'air ambiant, la PaO 2<8 кПа (60 мм рт. ст.) и/или SaO 2 <90% (причем РаСО 2 может и превышать, и не превышать 6,7 кПа), то это указывает на дыхательную недостаточность. Кроме того, если РаО 2 < 6,7 кП (50 мм рт. ст.), РаСО 2 >9,3 kPa (70 mm Hg) et pH<7,3, то это указывает на угрожающее жизни состояние, которое требует оказания интенсивной терапии.
Autres tests de laboratoire. Les analyses de sang peuvent montrer une polyglobulie (hématocrite > 55 %) ou une anémie. Le nombre de leucocytes n'est généralement pas très informatif. La présence d'expectorations purulentes lors d'une exacerbation est une raison suffisante pour démarrer une antibiothérapie. Les agents pathogènes les plus courants dans une exacerbation de la BPCO sont Streptococcus pneumoniae, Haemophilisinfluenzae et Moraxella catarrhalis. Des études biochimiques peuvent montrer si la cause de l'exacerbation est due à des troubles électrolytiques (hyponatrémie, -kaliémie, etc.), une décompensation du diabète sucré ou une malnutrition (carence en protéines), et peuvent également parler d'acidose métabolique.
Un exemple de diagnostic
La principale est la BPCO, IIIe, exacerbation sévère. Complication : cœur pulmonaire aigu, AHF. DNIIst.
Traitement
À la maison: l'exacerbation de la MPOC comprend l'augmentation de la dose et/ou de la fréquence du traitement bronchodilatateur. Si les médicaments anticholnergiques n'ont pas été utilisés auparavant, ils sont inclus dans le traitement jusqu'à ce que l'état s'améliore. Dans les cas plus graves, un traitement par nébuliseur à haute dose peut être prescrit au besoin pendant plusieurs jours. Cependant, après la disparition d'un épisode aigu, l'utilisation prolongée du nébuliseur pour le traitement de routine n'est pas recommandée. Les corticostéroïdes systémiques ont été utilisés avec succès pour traiter les exacerbations de la BPCO. Ils raccourcissent le temps de rémission et aident à restaurer la fonction pulmonaire plus rapidement. Leur utilisation doit être envisagée avec le VEMS 1<50% от должного. Рекомендуется преднизолон в дозе 40 мг в сутки в течение 10 дней. Антибиотики эффективны тогда, когда у больного с усилившейся одышкой и кашлем нарастает объем и гнойность отходящей мокроты.
Traitement hospitalier
Indications d'hospitalisation
Une augmentation significative de l'intensité des symptômes, comme l'apparition soudaine d'une dyspnée au repos
Pré-exacerbation sévère de la MPOC
Nouvelles manifestations cliniques (p. ex., cyanose, œdème périphérique)
Incapacité à arrêter l'exacerbation avec les médicaments initialement utilisés
Comorbidités graves
Arythmies nouvellement manifestées
Incertitude diagnostique
Âge des personnes âgées
Aide à domicile insuffisante
Indications d'orientation vers l'unité de soins intensifs
Dyspnée sévère avec réponse inadéquate au traitement d'urgence initial
Conscience confuse, léthargie, coma
Hypoxémie persistante ou aggravée (PaO 2<5,3 кПа, или 40 мм рт. ст.), и/или тяжелая/ухудшающаяся гиперкапния (PaCO 2 >8 kPa, ou 60 mm Hg. Art.), et/ou une acidose respiratoire sévère/aggravée (pH<7,25), несмотря на оксигенотерапию и неинвазивную вентиляцию легких
Traitement des exacerbations sévères mais non mortelles
1. Prescrire une oxygénothérapie guidée (2-5 L/min, au moins 18 h/jour) et répéter les mesures des gaz du sang artériel après 30 minutes
2. Bronchodilatateurs : augmenter la dose ou la fréquence d'administration, associer les bêta2-agonistes et les anticholinergiques, utiliser des espaceurs ou des nébuliseurs à compresseur (bromure d'ipratropium 0,25-0,5 mg (20-40 gouttes) via un nébuliseur avec O 2 en association avec des p-rami de bêta2-agonistes à courte durée d'action : salbutamol 2,5-5 mg ou fénotérol 0,5-1,0 mg (10-20 gouttes) après 6 heures Association de bêta2-agonistes et d'anticholinergiques - solution berodual 2 ml (40 gouttes) à travers un nébuliseur avec O 2, puis 1,5 à 2 ml après 6 heures dans la journée)
Considérer un en aminophylline (aminophylline 240 mg/h à 960 mg/jour à raison de 0,5 mg/kg/h sous guidage ECG)
3. Ajouter du GCS par voie orale ou intraveineuse (40 mg/jour pendant 10 jours, s'il est impossible d'administrer par voie parentérale par voie intraveineuse jusqu'à 3 mg/kg/jour)
4. S'il y a des signes d'infection bactérienne, envisagez des antibiotiques oraux ou intraveineux.
5. Tout au long du traitement : surveiller l'équilibre hydrique et nutritionnel, envisager l'héparine sous-cutanée, identifier et traiter les affections associées (par exemple, insuffisance cardiaque, arythmies), surveiller attentivement l'état du patient