Cu o pauză prelungită, când tabloul clinic lipsește pentru o perioadă impresionantă de timp, pacientului diagnosticat cu astm bronșic i se pare că boala s-a retras și nu vor mai exista exacerbări. Mai mult, starea de sănătate nu provoacă reclamații, iar capacitatea de a lucra rămâne la un nivel decent.
Dar aceasta este „insidiositatea” bolii, că un atac astmatic apare brusc, fără niciun motiv aparent la prima vedere sau chiar cu un contact minor cu unul sau alt alergen.
Deci, este posibil să se prevină exacerbarea astmului bronșic? Evitați-o? Sau merită să vă acordați un proces multianual care progresează constant?
Esența patologiei
Astm bronsic – boala cronica, care se caracterizează printr-un tablou clinic schimbător: exacerbarea bolii este înlocuită de o pauză lungă fără simptome astmatice. Pauza urmează din nou perioada acuta etc.
Și, deși sursele medicale descriu adesea astmul bronșic ca o boală inflamatorie care afectează sistemul respirator (în special arborele bronșic) și prescrie o serie de simptome și semne pentru boală, veriga cheie în patologie este bronhospasmul, denumită adesea obstrucție bronșică / atac de astm /.

Se manifestă sub formă tuse dureroasă neproductivă uscată, care este însoțită de disconfort sever în cufăr, precum și necesitatea de a depune eforturi suplimentare pentru a expira. Da, în caz de astm bronșic, expirația este cea care provoacă dificultăți din cauza edemului țesuturilor netede ale bronhiilor. Pentru a-i ameliora starea, pacientul la nivel mecanic ia o postură destul de specifică (ortopneea): așezat, picioarele depărtate, ușor înclinat înainte și sprijinindu-și mâinile pe ceva. În această poziție, este mai ușor pentru el să expire, deși acest lucru nu blochează atacul.
La fel de semnele însoțitoare ale exacerbării astmul bronșic este adesea considerat:
- dureri în piept;
- respirație șuierătoare la ascultarea bronhiilor;
- respirație slăbită;
- eliberarea unei cantități mici de spută incoloră după un atac de tuse;
- oboseală cronică, somnolență;
- tahicardie;
- senzație de respirație scurtă.
Pentru etiologie alergică bolile pot fi observate și rinită, erupții cutanate, lacrimare, strănut.
În funcție de frecvența și durata bronhospasmului, experții se identifică 4 grade principale de severitate boli:
- ușoară intermitentă (exacerbarea bolii nu durează mult, practic nu există atacuri nocturne);
- ușor persistent (procesele patologice sunt observate de mai multe ori pe săptămână, bunăstarea pacientului se înrăutățește semnificativ);
- mediu persistent (bronhospasmul se observă aproape în fiecare zi, capacitatea pacientului de a lucra scade, frecvența obstrucției bronșice noaptea depășește 1 dată pe săptămână);
- persistentă severă (atacurile de astm tulbură în fiecare zi, pacientul are dificultăți de respirație și se deplasează activ).
Cauza tuturor formelor menționate de exacerbare poate fi atât procesele imunologice, cât și cele neimunologice. Da, este agravată de expunerea la tot felul de alergeni. La rândul său, non-alergic este adesea provocat de mulți factori ai gospodăriei sau de stări generale de sănătate:
- boli respiratorii frecvente;
- oboseala fizică regulată;
- condiții de muncă dăunătoare la locul de muncă;
- o schimbare bruscă a condițiilor meteorologice;
- recepţie droguri;
- tendință spre alcoolism, fumatul de tutun;
- anularea bruscă a special medicamente tratamentul astmului bronșic.
Important! Astmaticii ar trebui să fie extrem de atenți la medicamente, deoarece mulți dintre ei, fără cercetări preliminare, pot provoca nu numai o exacerbare a bolii, ci și pot provoca șoc anafilactic... Se numește adesea forma clinică a bolii astmatice, care, în ciuda severității manifestării și a amenințării reale asupra vieții pacientului din cauza insuficienței respiratorii totale, poate fi oprită cu blocante speciale.
A doua formă este metabolică, nu este atât de acut, dar practic nu se pretează ușurării rapide și necesită o abordare mai atentă în condiții staționare.

Cum să ameliorezi rapid o exacerbare?
În funcție de originea bolii astmatice, se schimbă și algoritmul pentru îndepărtarea simptomelor acute.
Da, pentru astmul bronșic alergic este suficient să eliminați alergenul, care ar trebui să fie urmat de o ameliorare semnificativă a stării pacientului. Acest lucru se poate face cu ajutorul antihistaminicelor speciale (sub formă de tablete, injecții intramusculare, aerosoli).
Pentru astmatic boli de origine nealergică va fi necesar medicamente-blocante. Ele sunt adesea mai populare sub formă de inhalatoare, pe care pacienții sunt sfătuiți să le transporte cu ele pentru a evita un atac sever. La fel de importante sunt: terapia activă a bolilor sistemul respirator care ar putea provoca un atac de sufocare / tuse, respingerea obiceiurilor proaste, schimbarea reședinței într-una mai ecologică, stabilirea unei diete corecte.
Cand șoc anafilactic riscul de deces este semnificativ crescut, ceea ce necesită o ambulanță imediată, și anume administrarea subcutanată a unei soluții de adrenalină.
În orice situație, pacientul trebuie să înțeleagă că obstrucția bronșică este cu adevărat periculoasă și necesită o utilizare atentă a medicamentelor, evitarea alergenilor, suprasolicitare, crize nervoase.
Atenţie! Merită să vă echipați cu agenți de oprire nu numai pentru pacient, ci și pentru rudele acestuia. Într-adevăr, în momentul unui atac acut, panica poate împiedica o persoană astmatică să se orienteze și să se asigure.
Cum se tratează o exacerbare?
Aceasta nu înseamnă ameliorarea instantanee a bronhospasmului sau a acutului reactie alergica asupra acestui sau acelui „agent patogen”, și anume tratamentul astmului bronșic. Tratament, al cărui rezultat final ar trebui să fie o perioadă de „calm” absolut, lungă, fără un tablou clinic evident.

Multe surse medicale sugerează mai multe „obiective” oficiale pe care încearcă să îl realizeze prin compilarea unui algoritm pentru eliminarea exacerbării bolii astmatice:
- eliminarea eficientă a simptomelor bolii;
- obținerea controlului asupra simptomelor;
- stabilizarea sistemului respirator, ventilație pulmonară;
- creșterea performanței pacientului, îmbunătățirea bunăstării acestuia;
- îndepărtarea sindromului de obstrucție bronșică;
- următoarea exacerbare / efecte secundare terapie activă cu medicamente;
- prevenirea morții.
Pentru a implementa fiecare element din această listă, va fi necesar un plan clar de acțiune. Cu toate acestea, după cum arată practica, prima jumătate a acesteia este aproape identică, indiferent de etiologia bolii astmatice, precum și de severitatea acesteia:
- consultare de specialitate / apel la domiciliu al brigăzii de serviciu;
- examinarea detaliată a pacientului (de preferință într-un spital): analize generale(sânge / urină), radiografie, ECG, test alergen;
- studiul atacurilor de exacerbare (durata lor, severitatea, cauzele apariției);
- prescrierea unor medicamente speciale, verificarea răspunsului organismului la toleranța individuală.
Important! Medicul nu va trebui doar să prescrie medicamente eficiente, ci și să învețe pacientul să le folosească. Da, dacă este ușor să luați pastilele, atunci utilizarea inhalatorului / nebulizatorului / aerosolului poate ridica întrebări, în special la copiii mici și la vârstnici.
După stabilirea unui diagnostic precis, medicul curant va trebui să aleagă cel mai mult medicamente eficiente pentru pacientul dumneavoastră, precum și expuneți o serie de recomandări. Pentru astmul bronșic alergic:
- Eliminați alergenul dacă este deja cunoscut. În unele cazuri, acest lucru nu se poate face, deci va trebui să respectați cel puțin măsurile minime de siguranță, precum și să luați antihistaminice.
- Purtați întotdeauna un blocant de sufocare selectat de specialist. La urma urmei, destul de des sistemul imunitar organismul reacționează brusc nici măcar la alergen în sine, ci la „derivații” săi.
Pentru astmul non-alergic:
- Eliminați cauza exacerbării bolii (vindecare afectiuni respiratorii sistemul respirator, renunțați la hrana nesigură și dependențe, schimbați locul de muncă / locul de reședință, dacă condițiile lor de mediu au provocat progresia astmului bronșic).
- Luați medicamente în mod regulat, mergeți mai mult în aer curat.
- Limitați activitatea fizică, dar nu renunțați deloc.
Cum se tratează o exacerbare?
Această întrebare trebuie adresată numai unui specialist cu experiență, dar nu unui angajat al unui lanț de farmacii. Mai mult, nu este necesar să se implice în terapie Medicină tradițională fără a consulta în prealabil un medic.

Acest lucru nu înseamnă că este ineficient în raport cu astmul bronșic. Nu, unele remedii vor ajuta la prevenirea bronhospasmului și altele manifestari clinice boală, de exemplu decocturi rădăcină de lemn dulce și cimbru, muguri de pin, fructe de fenicul, frunze tinere de liliac, tincturi din ulei de măsline și usturoi.
Dar! Pentru a face acest lucru, ar trebui să fiți absolut sigur de o reacție pozitivă a corpului la una sau alta componentă a decoctului sau tincturii de vindecare.
Acțiunea mai rapidă se va dovedi a fi remedii tradiționale:
Atenţie! Toate medicamentele sunt prescrise în mod individual, în doze individuale. Mai mult, eficacitatea lor și prezența efectelor secundare sunt strict controlate de specialiști.
Un aspect important în eliminarea exacerbării astmului bronșic este atitudinea pacientului. La urma urmei, tabloul clinic principal poate fi provocat cu precizie sistem nervos... Din acest motiv, pacientului i se prescrie odihnă, odihnă, complexe de vitamine pentru întreținerea întregului corp, nutriție de înaltă calitate și terapie medicamentoasă... Dacă toate aceste condiții sunt îndeplinite, boala se va retrage rapid, fără a forța să-și amintească despre sine.
Video util
Asigurați-vă că urmăriți videoclipul dacă aveți un copil în vârstă de școală:
De fapt, orice pacient care intră în secția de terapie intensivă cu o exacerbare a astmului bronșic (BA) este diagnosticat cu astm bronșic de către specialiști. Astfel de norme sunt enunțate în ICD-10, dar acest lucru nu permite să se judece obiectiv severitatea procesului. Merită să ne amintim că diagnosticul „status asthmaticus” (SA) este un termen colectiv care combină diferite grade de severitate a exacerbării astmului. Unii experți sugerează că termenul „AS” în următorii ani va înceta să mai fie relevant. În recomandările pentru tratamentul astmului asocierii GINA (Inițiativa Globală pentru Astm) asociația „statusul astmatic! nu sunt menționate.
Dar aceste documente au stat la baza recomandărilor rusești pentru tratamentul astmului. Determinarea corectă de către medic a severității unei exacerbări a astmului bronșic face posibilă optimizarea tratamentului, găsirea pacienților care necesită o atenție maximă.
Conform datelor furnizate de experții GINA, Rusia ocupă primul loc în lume în ceea ce privește mortalitatea cauzată de astm. Unii cercetători spun că acest lucru se datorează nu numai calității îngrijirii, ci mai degrabă diagnosticului greșit al bolii. Medicii confundă adesea boala pulmonară obstructivă cronică (BPOC) cu AD. După cum știți, astmul pe termen lung este una dintre principalele cauze ale bolii pulmonare obstructive cronice. Atunci când un pacient cu astm bronșic are 60 de ani sau mai mult, medicii nu vor face o greșeală dacă reflectă BPOC în diagnostic.
Dacă vârsta pacientului nu depășește 35-40 de ani, diagnosticul de BPOC poate fi exclus. Problemă diagnostic diferentiat la persoanele cu vârsta de peste 40 de ani, este complicat de faptul că astmul și BPOC pot fi observate simultan. Dar adesea manifestările BPOC, chiar dacă pacientul nu a fost niciodată bolnav astm bronsic sunt luate pentru exacerbarea astmului. Acesta este cel mai rău caz, deoarece tratamentul pentru aceste boli este foarte diferit.
De asemenea, aceste boli diferă foarte mult în ceea ce privește rezultatele. BPOC se caracterizează prin progresia bolii și lipsa reversibilității. Pentru AD, reversibilitatea este tipică, o dinamică pozitivă bună pentru tratamentul efectuat corect, cursul ondulant. Trebuie avut în vedere faptul că, dacă o exacerbare a astmului bronșic nu se pretează terapiei discutate mai jos, este probabil ca principala patologie să fie BPOC.
Cauzele exacerbării astmului bronșic
Cel mai adesea, cauza declanșatoare este virală, mai rar - infecții bacteriene, condiții de mediu nefavorabile, diverși alergeni, erori în tratamentul astmului diagnosticat.
Inspecție și monitorizare
Toți pacienții sunt supuși unei radiografii a plămânilor. Monitorizat tensiune arteriala, Ritm cardiac, gaze sanguine, ECG, debitul expirator de vârf (PEF), electroliți din sânge, hematocrit, glucoză, creatinină, saturație sanguină. De asemenea, se efectuează o evaluare dinamică a simptomelor clinice.
Medicii determină severitatea unei exacerbări în conformitate cu tabelul:
|
Severitatea exacerbării BA |
|||||||||
|
Severitate medie |
Potențial fatal |
||||||||
|
La mers |
Când vorbești |
||||||||
|
Propuneri |
|||||||||
|
Șuierătoare |
Adesea numai la expirație |
Adesea tare |
Absent |
||||||
|
Poziţie |
Poate minți |
Prefer să stai |
Stați aplecându-vă înainte |
||||||
|
Nivelul de veghe |
Uneori entuziasmat |
De obicei agitat |
De obicei agitat |
Inhibat sau mintea confuză |
|||||
|
Implicarea mușchilor accesorii în actul respirației și scufundării fosa supraclaviculară |
De obicei există |
De obicei există |
Mișcări paradoxale pieptul și pereții abdominali |
||||||
|
Bradicardie |
|||||||||
|
A crescut |
A crescut |
||||||||
|
PSV * măsoară 30-60 de minute după prima injecție bronhodilatator în% din datorat sau cel mai bun valoarea individuală |
Mai mult de 80% din datorii sau cele mai bune valorile individuale |
60-80% din datorate sau cele mai bune valorile individuale |
<60% от должных или наилучших valorile individuale (<100 л/мин у взрослых) sau efectul durează mai puțin de 2 ore |
||||||
|
SpO2,% (când respirați aer) |
|||||||||
|
PaO2 (când respirați aer) |
Peste 60 mm Hg. Artă. |
Mai puțin de 60 mm Hg Artă. Cianoză posibilă |
|||||||
|
Mai puțin de 45 mmHg Artă. |
Mai mult de 45 mm Hg Artă. |
||||||||
|
*Notă. Valorile aproximative ale debitului expirator de vârf la bărbații adulți sănătoși sunt de 500-600 l / min, pentru femei - 350-500 l / min. |
|||||||||
Tratamentul exacerbării astmului bronșic
Pentru orice severitate a exacerbării astmului, sunt prescrise corticosteroizi și beta-2 agoniști inhalatori. Tratamentul trebuie efectuat în această ordine:
- Terapia cu oxigen
Pacientul ia o poziție forțată așezată sau semi-așezată. Medicul curant ar trebui să îi avertizeze pe asistentele din secție să nu încerce să pună pacientul în poziția „culcat”.
Hipoxia este principala cauză de deces în exacerbările astmului. Prin urmare, dacă o persoană are hipoxemie, oxigenul trebuie prescris cât mai curând posibil. Medicii ajustează debitul de oxigen pentru a se asigura că un nivel de SpO2 este mai mare de 92%. Chiar și concentrațiile mari de oxigen (FiO2> 0,7) în amestecul respirator cresc doar nesemnificativ PaCO2 și nu duc la depresia centrului respirator.
- Bronhodilatatoare inhalate
Merită să ne amintim că pentru administrarea prin inhalare a bronhodilatatoarelor, atât un nebulizator, cât și inhalatoarele cu aerosoli cu doză măsurată pot fi utilizate cu o eficiență egală. Bronhodilatatoarele inhalate sunt alese pentru tratamentul exacerbărilor astmului bronșic de orice severitate. În majoritatea cazurilor, numai beta-2-agoniști pot fi administrați pacientului.
În cazurile severe, este necesară inhalarea beta-2-agoniștilor împreună cu anticolinergice. Se recomandă utilizarea unei combinații de beta-2-agonist + anticolinergic (bromură de ipratropiu) pentru exacerbarea severă a astmului; cu efect insuficient al tratamentului în curs cu beta-2-agoniști; la pacienții cu vârsta peste 60 de ani și la orice vârstă, dacă medicul a observat semne de BPOC la pacient.
Dacă pacientul înainte de internare la UTI nu a luat beta-2-agoniști așa cum i-a prescris medicul sau i-a primit în doze normale, atunci este mai bine să continuați inhalarea beta-2-agonistului care a fost anterior cel mai eficient pentru tratarea acest pacient (întreabă-se pe sine sau rude).
- Folosind un nebulizator
Procedura de inhalare a medicamentelor printr-un nebulizator durează mult, iar hipoxemia este frecventă la pacienți, de aceea se recomandă utilizarea unui nebulizator acționat pneumatic dintr-o linie de oxigen.
Mai des iau soluții speciale pentru inhalare:
Agonist selectiv al receptorilor beta-2-adrenergici. Metoda de aplicare: utilizarea unui nebulizator; nebuloasă de 2,5 ml, care conține 2,5 mg de salbutamol în soluție salină. Pentru inhalare sunt prescrise 1-2 nebule (2,5-5,0 mg) sub formă nediluată. Dacă nu există nicio îmbunătățire, medicii repetă inhalări de 2,5 mg la fiecare 20 de minute timp de o oră. După aceea, 2,5-10 mg la fiecare 1-4 ore, după cum este necesar, sau 10-15 mg pe oră continuu.
1 ml (20 picături) de soluție pentru inhalare conține 500 μg de bromhidrat de fenoterol și 250 μg de bromură de ipratropiu. Ar trebui să inhalați 1 ml (20 picături) de berodual în 3-4 ml de soluție fiziologică sau 25% soluție de sulfat de magneziu timp de 5-10 minute, până când soluția este complet utilizată. Dacă nu există nicio îmbunătățire, este necesară a doua inhalare după 20 de minute.
Medicii își amintesc că sulfatul de magneziu demonstrează proprietățile unui bronhodilatator atât atunci când este administrat intravenos, cât și când este inhalat. Deși medicamentul este oarecum inferior ca eficacitate atât la beta-2-agoniști, cât și la anticolinergice. Dar dacă se utilizează 5-8 ml de sulfat de magneziu 25% în locul clorurii de sodiu 0,9% ca solvent pentru beta-2-agoniști, se poate observa un efect broșolitic comun mai pronunțat.
Bromură de ipratropiu prin nebulizator: 0,5 miligrame la fiecare 20 de minute pentru până la 3 doze, după care este necesar. Pentru acest medicament, atunci când este administrat prin inhalare, o absorbție extrem de scăzută din membrana mucoasă a căilor respiratorii este tipică și, prin urmare, nu are un efect sistemic.
Inhalatoare dozate măsurate
Pentru utilizarea eficientă a inhalatoarelor cu doză măsurată, este important ca acestea să fie echipate cu un distanțier, de preferință un volum mare (0,5-1 litru), deoarece unora le este greu să își coordoneze inhalarea cu inhalarea. Dacă nu este disponibil niciun distanțier, acesta poate fi realizat destul de repede dintr-o sticlă obișnuită din plastic sau orice alt recipient adecvat.
Cu o exacerbare a astmului bronșic, se prescriu beta-2-agoniști cu acțiune scurtă - sulfat de terbutalină (1 doză - 250 μg), salbutamol (1 doză - 100 μg), (1 doză - 200 μg), Berodual (o doză de berodual conține 0,05 mg fenoterol și 0,02 mg bromură de ipratropiu). Inițial, pacientul, cu un interval de câteva secunde între inhalări, inhalează secvențial de la patru la opt doze ale unuia dintre medicamentele de mai sus. După - 1-2 doze în 10-20 minute până când starea se ameliorează sau apar reacții adverse - tahicardie, tremurături severe. După aceea, dacă este necesar - 1-2 doze în 1-4 ore.
Inhalarea bromurii de ipratropiu printr-un inhalator cu doză măsurată - 8 respirații la fiecare 20 de minute, dacă este necesar, repetați timp de 3 ore.
Complicații
Atunci când se utilizează agoniști beta-2, trebuie luate în considerare contraindicațiile acestora: aritmii cardiace, hipertensiune arterială severă și altele. De asemenea, trebuie să controlați concentrația de potasiu în plasmă - se poate dezvolta hipokaliemie. Dacă pacientul prezintă semne de supradozaj cu beta-2-agoniști, aceștia trebuie opriți imediat. Dar după 4-5 ore este necesar să începeți să luați din nou medicamente. Pacienții cu exacerbarea astmului ar trebui să ia aceste medicamente până când apare o îmbunătățire durabilă a stării lor.
Corticosteroizi
Este important de luat în considerare: corticosteroizii sunt prescriși tuturor pacienților cu exacerbarea astmului bronșic, indiferent de gravitate și imediat după internare, fără întârziere. Un rol semnificativ în dezvoltarea exacerbării astmului îl joacă nu numai bronhospasmul, ci și inflamația, edemul, diskinezia căilor respiratorii mici și înfundarea lor cu spută vâscoasă. Prin urmare, corticosteroizii, care au un efect antiinflamator pronunțat, sunt importanți pentru tratamentul astmului. Corticosteroizii pot fi administrați fie intravenos, fie enteral, iar efectul va fi același.
Un efect semnificativ clinic după administrarea lor se dezvoltă după 2-4 ore: în medie, după 1-6 ore cu administrare intravenoasă. Cu administrare enterală - puțin mai târziu. Cercetările sugerează că dozele relativ mici de corticosteroizi (40-80 mg / zi) sunt la fel de eficiente ca dozele relativ mari de metilprednisolon, 200-300 mg / zi. Nu s-a dovedit că utilizarea dozelor ultra-mari (terapie cu puls) de prednisolon (1-2 g pe zi) poate îmbunătăți rezultatele terapiei. Adică, există un fel de efect prag.
Pacienților cu exacerbare ușoară până la moderată li se poate atribui cale de administrare enterală sau prin inhalare. Metoda aleasă este metilprednisolonă sau prednisolonă enteră la o doză de 60-80 mg pe zi pentru 1-3 doze. Pentru exacerbările severe sau potențial fatale ale astmului, cel mai bine este să utilizați calea de administrare intravenoasă a corticosteroizilor.
Majoritatea experților aleg o doză de 1,5-2 mg / kg pe zi de prednisolon IV, împărțită în 4 doze. A doua zi, administrarea medicamentului trebuie repetată - la aceeași doză și cu aceeași frecvență de administrare. În următoarele zile, doza de prednisolon trebuie redusă - cu 60-90 mg pe zi intravenos sau enteral timp de 5-7 zile sau până când starea persoanei este stabilă.
În loc de prednisolon cu practic aceeași eficacitate, se poate atribui dexametazonă 4 mg IV de 3 ori pe zi sau hidrocortizon 125-250 mg IV de 4 ori pe zi. În comparație cu prednisolonul, dexametazona are un efect biologic mai lung. Din acest motiv, durata cursului poate fi de până la 4-5 zile. Doza nu trebuie redusă treptat. Merită să ne amintim: în caz de exacerbare severă, corticosteroizii inhalați sunt prescriși de medici numai după o îmbunătățire constantă a stării pacientului.
Sulfat de magneziu
Administrarea intravenoasă de sulfat de magneziu a fost inclusă în toate recomandările ca terapie secundară, atât la pacienții adulți, cât și la copii. Sulfatul de magneziu este prescris în cazul unui efect insuficient din utilizarea beta-2-agoniștilor; cu exacerbare severă a astmului bronșic, în care există obstrucție bronșică severă.
Înainte de numirea sulfatului de magneziu, hipovolemia trebuie eliminată, SBP trebuie să fie peste 100 mm Hg. Artă. Important: dacă o persoană are o exacerbare potențial letală, atunci sulfatul de magneziu este prescris numai după ce persoana este transferată la respirație controlată și stabilizare hemodinamică.
Majoritatea experților recomandă introducerea a 2 g de sulfat de magneziu în 20 de minute. Conform opiniei subiective a unor cercetători, această metodă de introducere a sulfatului de magneziu este eficientă: 20 ml dintr-o soluție 25% (5 grame) se injectează intravenos timp de 15-20 de minute, apoi perfuzie intravenoasă cu o rată de 1-2 g pe oră până la eliminarea bronhospasmului. În același timp, potrivit cercetătorilor, aceștia nu au observat niciodată o creștere a nivelului de magneziu din sânge peste nivelul terapeutic - 2-4 mmol pe litru. Numirea sulfatului de magneziu trebuie să fie atentă dacă o persoană are simptome de insuficiență renală sau hipotensiune arterială.
Tratamente suplimentare pentru bronhospasm
Următoarele medicamente nu sunt prescrise în mod obișnuit. Dacă nu există bronhodilatatoare inhalate, un efect suficient din terapia prin inhalare sau pacientul nu este în măsură să o efectueze eficient, medicii utilizează administrarea intravenoasă de beta-2-agoniști: salbutamol (doză de încărcare și întreținere), epinefrină (adrenalină). Astăzi, medicii nu folosesc (Euphyllin) pentru tratamentul exacerbării astmului, deoarece provoacă o serie de efecte secundare grave, inclusiv tremurături, tahicardie și scaune libere.
În exacerbarea severă, aminofilina are efectul dorit în astfel de cazuri:
- Dacă în termen de 2 ore de la numirea beta-2-agoniștilor, în / în administrarea sulfatului de magneziu, nu există un efect pozitiv vizibil;
- Dacă nu este posibil să se utilizeze bronhodilatatoare inhalate.
Terapia respiratorie
În plus față de terapia medicamentoasă, mulți pacienți necesită ventilație mecanică.
Ventilație neinvazivă (NIV)
Unii cercetători au mari îndoieli cu privire la oportunitatea utilizării NIV la pacienții cu exacerbare fatală a astmului bronșic. Dar, potrivit entuziaștilor care folosesc această metodă în status asthmaticus, în multe cazuri a fost posibil să se evite intubația traheală și ventilația mecanică invazivă.
Ventilația artificială (mecanică) a plămânilor
Ventilația începe în următoarele condiții:
- Apariția precursorilor de coma (cianoză, somnolență, confuzie);
- Lipsa efectului din tratamentul utilizat în prezent;
- Piept mut, cianoză, respirație slabă;
- Creșterea hipercapniei cu peste 60 mm Hg. Artă. pe fondul hipoxemiei (PaO2 55-65 mm Hg, SpO2 mai puțin de 90%.)
- Bradicardie sau hipotensiune arterială;
- Creșterea oboselii și epuizarea pacientului;
- Debitul expirator maxim este mai mic de 30% din valoarea obișnuită a pacientului.
Tehnologia de ventilație
Cel mai bine este să infuzați soluții saline într-un volum de 400-800 ml înainte de începerea ventilării mecanice pentru a reduce riscul de hipotensiune. După intubație și începutul ventilației mecanice, datorită supra-umflării alveolelor, presiunii intratoracale crescute și auto-PEEP ridicat, există o mare probabilitate de scădere bruscă a umplerii ventriculului drept cu sânge. Consecința va fi dezvoltarea hipotensiunii. Este necesar să se acorde primul ajutor imediat în prealabil pentru a prepara o soluție de lucru de catecolamină (de obicei epinefrină (adrenalină) - se diluează 1 mg de epinefrină în 10,0 0,9% clorură de sodiu). În caz de hipotensiune, se recomandă injectarea intravenoasă a 0,5-1 ml.
Preoxigenare. Intubația traheală se face cel mai bine cu inhalarea de oxigen 100%. Pentru a reduce rezistența la expirație, medicii folosesc un tub endotraheal cu diametrul cel mai mare pentru o persoană dată.
Inducția se efectuează - 1-2 mg pe 1 kg din corpul pacientului sau propofol - 1-3 mg / kg. Pentru sedare în primele 2-4 ore, cel mai bine este să utilizați o infuzie de ketamină de 2-4 mg / kg / oră, deoarece are un efect broșolitic mai pronunțat decât alte hipnotice. După o anumită stabilizare a pacientului și reducerea bronhospasmului, perfuzia cu ketamină, propofol sau amestecul acestora (ketofol) este de obicei folosită pentru sedare.Succinilcolina 1,5 mg / kg este de obicei utilizată ca relaxant muscular pentru intubație.
Durata ventilației mecanice este de 3-8 ore pentru majoritatea pacienților cu o exacerbare potențial fatală și de obicei nu se efectuează mai mult de 2-3 zile. Criteriile pentru transferul pacientului la respirația spontană sunt tradiționale: hemodinamică stabilă, conștiință clară a pacientului, presiune inspiratorie în sistemul pacient-respirator cu mai puțin de 25 mm de apă. Art. PaO2 este mai mare de 65 mm Hg. Art. SpO2 mai mult de 90% cu FiO2 30-40%. Există o respirație spontană a unei persoane.
Terapia prin perfuzie
Această metodă este relevantă dacă pacientul nu poate bea apă de unul singur sau medicul înregistrează semne de deshidratare, hipotensiune. Pacienții au adesea insuficiență ventriculară dreaptă, astfel încât hipervolemia și volumele mari de lichide sunt contraindicate.
Infuzia utilizând soluții saline standard se efectuează: înainte de începerea ventilației mecanice, într-un volum de 2-3 litri pe zi intravenos în timpul ventilației mecanice, dacă nu se efectuează introducerea tubului de alimente și lichide.
Sub exacerbarea astmului bronșicînțelege episoadele de creștere progresivă a dispneei expiratorii, tuse, respirație șuierătoare sau diverse combinații ale acestor simptome.
Exacerbările se caracterizează printr-o creștere progresivă a obstrucției bronșice, care este evaluată prin modificarea volumului expirator forțat în 1 sec. (FEV1) sau debitul expirator de vârf (PEF), precum și o creștere a variabilității PEF cu monitorizarea zilnică a acestui indicator. Acești indicatori reflectă mai obiectiv severitatea exacerbării astmului bronșic decât simptomele clinice.
Clasificarea severității exacerbării astmului bronșic: După severitate, puteți distinge exacerbările ușoare, moderate și severe ale astmului.
Agravare ușoară: activitatea fizică este păstrată, dificultăți de respirație la mers, vorbire - propoziții, pacientul poate fi agitat, frecvența respiratorie este crescută, mușchii auxiliari nu sunt de obicei implicați în actul respirației, există puține respirații șuierătoare în timpul auscultării plămânilor , de obicei la sfârșitul expirației, ritmul cardiac este mai mic de 100 pe minut, pulsul paradoxal este absent sau mai mic de 10 mm Hg. Art., Debitul expirator de vârf (PSV) după administrarea unui bronhodilatator este mai mare de 80% din valorile corecte sau individuale cele mai bune pentru pacient, oxigenul Ra este norma, testul nu este de obicei necesar, dioxidul de carbon Ra este mai puțin de 45 mm Hg. Artă. (conform recomandărilor experților EPR-2 - 42 mm Hg), Sa (saturație) de oxigen este mai mare de 95%.
Exacerbare moderată: activitatea fizică este limitată, dificultăți de respirație atunci când vorbește, vorbește - fraze, pacientul este de obicei agitat, frecvența respiratorie este crescută, mușchii auxiliari sunt cel mai adesea implicați în actul respirației, în timpul auscultației plămânilor - raliuri puternice, fluierătoare de-a lungul întregii expirații, ritmul cardiac - 100-120 pe minut, poate exista un impuls paradoxal de 10-25 mm Hg, debitul expirator maxim (PSV) după administrarea unui bronhodilatator 60-80 la sută din cele mai bune sau individuale cele mai bune valori Pentru pacient (conform recomandărilor experților EPR-2 - 50-80%), oxigen Ra mai mare de 60 mm Hg, dioxid de carbon Ra mai mic de 45 mm Hg, oxigen Sa 91-95%.
Exacerbare severă: activitatea fizică este brusc redusă sau absentă, dificultăți de respirație în repaus, vorbire colocvială - cuvinte separate, pacientul este agitat, frecvența respiratorie este mai mare de 30 pe minut, mușchii auxiliari sunt întotdeauna implicați în actul respirației, în timpul auscultării plămânii - raluri puternice, fluierătoare în timpul inhalării și expirației, frecvență cardiacă mai mare de 120 pe minut, puls paradoxal mai mare de 25 mm Hg. Art., Debitul expirator de vârf (PSV) după administrarea unui bronhodilatator este mai mic de 60% din valorile corecte sau individuale cele mai bune pentru pacient (conform recomandărilor EPR-2, mai puțin de 50%) sau 100 litri pe minut sau răspunsul durează mai puțin de 2 ore, oxigen Ra mai mic de 60 mm Hg, este posibilă cianoză, Ra dioxid de carbon este mai mare de 45 mm Hg, Sa oxigen este mai mic de 90%.
Exacerbare care pune viața în pericol: activitatea fizică este redusă sau absentă brusc, dificultăți de respirație în repaus, vorbirea vorbită este absentă, tulburări de conștiență (surditate sau stupoare, poate exista comă), frecvența respiratorie este crescută sau scăzută, participarea mușchilor auxiliari în actul respirației - mișcări toraco-abdominale paradoxale, șuieratul în timpul auscultației plămânilor șuieratul este absent, respirația este superficială, plămânul „mut”, bradicardia, absența unui puls paradoxal indică oboseală musculară, debitul expirator maxim după administrarea unui bronhodilatator este mai mic de 33% dintre cele mai bune sau individuale cele mai bune valori pentru pacient, oxigen Ra mai mic de 60 mm Hg, cianoză, dioxid de carbon Ra mai mare de 45 mm Hg, oxigen Sa mai mic de 90%.
Prezența mai multor parametri (nu neapărat toți) vă permite să faceți o descriere generală a exacerbării. Mulți dintre acești parametri nu au fost cercetați în mod sistematic și, prin urmare, sunt doar orientativi.
Trebuie remarcat faptul că severitatea exacerbării nu este sinonimă cu severitatea evoluției astmului bronșic, deși există o anumită legătură între ele. Deci, o formă ușoară de exacerbare, de regulă, se caracterizează prin boli ușoare. În astmul moderat până la sever, pot apărea exacerbări ușoare, moderate și severe.
Tacticile de tratare a astmului bronșic sunt determinate de stadiul în care se desfășoară: acasă, ambulanță, spital.
Algoritmul pentru tratarea exacerbării astmului bronșic, indiferent de severitatea acestuia, are mai multe principii generale:
1. În timpul examinării inițiale, este necesar să se evalueze gravitatea atacului, să se efectueze debitmetria de vârf, dacă este posibil, oximetrie de puls (în spital - ECG, raze X, studiu de potasiu seric, gaze din sânge).
2. Efectuați un examen fizic pentru a evalua severitatea exacerbării și a identifica posibile complicații (pneumotorax, pneumomediastin, atelectazie, pneumonie etc.).
3. Determinați natura terapiei anterioare (numărul de doze ale bronhodilatatorului, calea de administrare, timpul scurs de la ultima administrare a bronhodilatatorului, dacă s-au utilizat glucocorticosteroizi (GCS), dozele acestora).
4. Clarificați durata exacerbării și cauzele posibile ale acesteia, precedând spitalizarea pentru astm bronșic, prezența unor stări astmatice (sau exacerbări severe ale astmului) în istorie.
5. Îndepărtați alergenii cauzali sau declanșatorii de exacerbare (dacă sunt cunoscuți).
6. Efectuarea terapiei de urgență, în funcție de gravitatea exacerbării. Pe parcursul terapiei și monitorizării, severitatea exacerbării poate fi revizuită.
7. Observarea dinamicii simptomelor clinice, monitorizarea debitului expirator maxim (PSV), oxigen Sa, gaze din sânge.
8. Învățarea pacientului să utilizeze un nebulizator și un inhalator de aerosoli cu doză măsurată.
În timpul examinării, se acordă atenție prezenței semnelor la pacient care indică dezvoltarea unei exacerbări severe sau care pun viața în pericol a astmului - conștiință afectată, dificultăți de respirație severe, datorită cărora pacientul pronunță doar cuvinte unice sau fraze scurte, participarea la respirația mușchilor auxiliari, paloare, cianoză, lipsa zgomotului respirator la auscultație, emfizem subcutanat, puls paradoxal mai mare de 25 mm Hg. Artă. (în condiții de urgență, pulsul paradoxal este determinat de primul ton Korotkov la înălțimea inspiratorie și la adâncimea expiratorie - dacă diferența este mai mare de 12 mm Hg, atunci pulsul paradoxal este considerat pozitiv), debitul de vârf expirator ( PSV) este mai puțin de 50-60 la sută din valoarea datorată sau cea mai bună pentru pacient, sau mai puțin de 100 de litri pe minut.
Dacă starea inițială a pacientului este evaluată ca fiind ușoară sau moderată, este necesar să începeți inhalarea beta-agoniștilor fie printr-un inhalator cu doză măsurată cu un distanțier de volum mare (doza inițială 400-800 mcg), fie printr-un nebulizator (doza inițială 2,5-5 mg) ... La 15-20 de minute după inhalare, se ajunge la o concluzie cu privire la gravitatea exacerbării astmului bronșic.
Algoritm pentru tratamentul exacerbării ușoare a astmului bronșic în etapa „îngrijire ambulatorie - ambulanță”
Dacă, conform criteriilor, starea pacientului este evaluată ca fiind ușoară (PSV este mai mare de 80% din valoarea cea mai bună sau individuală la 20 de minute după inhalarea a 400 μg de beta-agonist cu acțiune scurtă printr-un distanțier sau 2,5 mg printr-un nebulizator, nu există respirație șuierătoare sau dificultăți de respirație, efectul beta-2-agoniști durează 4 ore).
În cazul unei exacerbări ușoare, pacientul poate efectua complet cursul terapiei de exacerbare pe cont propriu, în conformitate cu un plan întocmit în prealabil (de preferință, observația medicului în primele două sau trei zile).
În caz de exacerbare a astmului bronșic ușor, se recomandă:
1. Continuați să inhalați beta-agoniști la fiecare 3-4 ore timp de 1-2 zile.
2. Pentru prevenirea atacurilor de dispnee, este necesar să se prescrie sau să se modifice tratamentul antiinflamator: corticosteroizi inhalatori în doze medii sau mari, dacă pacientul nu le-a primit înainte sau o creștere a dozei de glucocorticosteroizi inhalatori de 2 ori , dacă pacientul le-a luat deja.
3. Pacientul ar trebui să fie sub supravegherea ambulatorie a unui pneumolog sau terapeut pentru a monitoriza eficacitatea terapiei.
Algoritm pentru tratamentul exacerbării moderate în etapele „îngrijire ambulatorie - ambulanță”
Dacă, conform criteriilor, starea pacientului este evaluată ca fiind moderată (PSV este mai mare de 50%, dar mai puțin de 80% din cea mai bună valoare individuală sau adecvată după inhalarea a 400 μg de beta-agonist cu acțiune scurtă prin distanțier sau 2,5 mg printr-un nebulizator), pacientul:
1. Continuă inhalarea beta-agoniștilor 2 printr-un nebulizator (2,5 mg) sau inhalator cu doză măsurată cu un distanțier de volum mare (400 μg) de trei ori într-o oră.
2. Prescrieți steroizi sistemici (30-60 mg o dată).
Cu o tendință pozitivă într-o oră (PSV este mai mult de 80% din valoarea corectă sau individual mai bună), pacientul poate fi lăsat acasă.
Pacientul trebuie:
1. Continuă inhalarea beta-agoniștilor 2,5 mg printr-un nebulizator sau 400 μg printr-un distanțier la fiecare 4 ore timp de 2 zile.
2. Luați steroizi sistemici în doză de 40-60 mg în una sau două doze timp de 3-10 zile.
Dacă pacientul a primit anterior corticosteroizi inhalatori, se recomandă dublarea dozei. Dacă pacientul nu a luat corticosteroizi inhalatori, atunci este necesar să începeți administrarea lor în doze medii sau mari.
Pacientul trebuie monitorizat timp de 3-7 zile, deoarece rămâne probabilitatea unei exacerbări repetate.
Dacă într-o altă oră cu exacerbare moderată efectul terapiei este incomplet sau absent, atunci pacientul trebuie să solicite imediat ajutor medical și trebuie internat în secția de pneumologie sau în unitatea de terapie intensivă.
La transportul unui pacient într-o mașină de ambulanță, se continuă inhalarea beta-agoniștilor, se adaugă inhalarea atroventului, care se administrează folosind un nebulizator (0,5 mg) sau un distanțier (4-8 respirații) la fiecare 30 de minute de 3 ori, apoi la fiecare 2-4 ore după cum este necesar. Puteți amesteca salbutamol și atrovent în același nebulizator. Terapia cu oxigen, dacă este posibil.
Algoritm pentru tratamentul exacerbării severe în etapele „îngrijire ambulatorie - ambulanță - spital”
Dacă, într-o altă oră cu exacerbare moderată, efectul terapiei este incomplet sau absent, dacă inițial sau după prima oră de terapie, se concluzionează că pacientul aregreu(PSV mai puțin de 50-60% din cauza, frecvența respiratorie mai mare de 25 pe minut, frecvența cardiacă mai mare de 110 pe minut, dificultăți de respirație în timpul conversației - incapacitate de a pronunța o frază, propoziție la o singură expirație) saucare pune viața în pericol (PSV mai puțin de 33% din cauza, „plămânul mut”, cianoză, efort respirator slab, bradicardie sau hipotensiune arterială, slăbiciune generală, confuzie sau comă) exacerbări, pacientul ar trebui să caute imediat ajutor medical și ar trebui să fie internat într-un sistem pulmonar sau intensiv unitate de îngrijire ...
Indicațiile pentru spitalizarea pacienților cu astm bronșic sunt:
1. exacerbarea astmului bronșic moderat în absența efectului tratamentului în decurs de o oră.
2. Exacerbarea severă și care pune viața în pericol a astmului bronșic. Lipsa condițiilor pentru furnizarea de îngrijiri calificate și observarea pacientului în dinamică în stadiul ambulatoriu.
4. Pacienții care prezintă riscul unui rezultat nefavorabil al bolii.
Când se colectează o anamneză la un pacient cu exacerbarea astmului bronșic, este necesar să se analizeze cu atenție prezența factorilor asociați cu dezvoltarea unei exacerbări care pune viața în pericol (grup de risc pentru un rezultat nefavorabil).
Acestea includ:
1. O istorie de exacerbare a astmului bronșic care pune viața în pericol.
2. Un istoric al unui episod de ventilație mecanică pentru exacerbarea astmului bronșic.
3. Antecedente de pneumotorax sau pneumomediastin.
4. Spitalizare sau tratament medical de urgență în ultima lună.
5. Peste două internări în ultimul an.
6. Peste trei apeluri pentru asistență medicală de urgență în ultimul an.
7. Utilizarea a mai mult de 2 cutii de beta-agoniști cu acțiune scurtă în ultima lună.
8. Scăderea recentă sau încetarea completă a corticosteroizilor.
9. Prezența bolilor concomitente (de exemplu, boli ale sistemului cardiovascular sau boli pulmonare obstructive cronice).
10. Probleme psihologice (negarea bolii).
11. Factori socio-economici (venituri mici, indisponibilitatea medicamentelor).
12. Aderența scăzută la terapie.
Tratamentul exacerbării în spital.
În exacerbarea severă și care pune viața în pericol, starea pacientului este evaluată la fiecare 15-30 de minute.
Monitorizarea pacientului include:
1. Evaluarea simptomelor clinice
2. Determinarea PSV sau FEV1
3. Determinarea compoziției oxigenului Sa și a gazelor arteriale din sânge la oxigenul Sa mai mic de 92%
4. Determinarea stării acido-bazice
5. Determinarea conținutului de potasiu în serul sanguin
6. ECG
7. Radiografia organelor toracice (la internare).
Inițierea tratamentului nu trebuie întârziată din cauza măsurătorilor de laborator. Anamneza și examinarea fizică a pacientului în timpul unei exacerbări sunt importante pentru alegerea tratamentului ulterior.
La examinarea inițială a pacientului, este necesar:
1. Evaluați severitatea exacerbării, efectuați debitul de vârf cu determinarea PSV.
2. Determinați natura terapiei anterioare: bronhodilatatoare, glucocorticoizi și dozele acestora.
3. Clarificați durata exacerbării și cauzele posibile ale acesteia, precedând spitalizarea pentru astm bronșic, prezența stării astmatice (sau TOA) în anamneză.
4. Efectuați un examen fizic pentru a evalua severitatea exacerbării și a identifica posibile complicații (pneumotorax, pneumomediastin, atelectazie etc.).
Inhalarea constantă a oxigenului umidificat utilizând catetere nazale sau măști Venturi (40-60% oxigen Fi) este necesară până când saturația oxigenului este mai mare de 90%.
Continuă sau începe (dacă pacientul nu a fost repartizat anterior) să ia corticosteroizi sistemici.
Indicațiile pentru numirea GCS pentru exacerbarea astmului sunt:
1. Ineficacitatea utilizării beta-agoniștilor cu acțiune scurtă.
2. Exacerbări ale astmului moderate, severe sau care pun viața în pericol.
3. Pacienți dependenți de hormoni.
1. Experții EPR-2 recomandă prescrierea corticosteroizilor sistemici (prednison, prednisolon, metilprednisolon) 120-180 mg / zi pe cale orală în trei sau patru doze timp de 48 de ore, apoi 60-80 mg / zi până când PSV atinge 70% din cantitatea adecvată sau individuală cel mai bun indicator, după care 40-60 mg pe zi sunt reținute pe cale orală în una sau două doze. Este posibil să se utilizeze hidrocortizon 200 mg intravenos.
2. Societățile britanice toracice și canadiene recomandă alte doze: 30-60 mg / zi de prednisolon oral sau hidrocortizon 200 mg IV la fiecare 6 ore. Doza zilnică prescrisă de medicament este menținută fără o scădere timp de 7-14 zile sau până când dispar simptomele nocturne ale astmului bronșic, activitatea fizică se normalizează, PSV crește la cele mai bune valori pentru pacient (80% din indicatorul maxim ), urmată de o anulare cu un singur pas a medicamentului (dacă pacientul nu a primit anterior corticosteroizi sistemici ca terapie de bază). În același timp, este indicată în special posibilitatea unei întreruperi într-o etapă a medicamentului cu o durată a terapiei GCS de 15 zile sau mai puțin.
Ca terapie bronhodilatatoare, se utilizează o combinație de beta-agoniști și anticolinergici, care se administrează printr-un nebulizator sau distanțier la fiecare 20 de minute timp de încă o oră.
Dacă la 20 de minute de la ultima inhalare de PSV mai mult de 50% din valoarea corectă sau individuală a pacientului, starea clinică a pacientului s-a îmbunătățit, atunci inhalarea ventolinei (posibil în combinație cu anticolinergice) se continuă la 2,5 mg printr-un nebulizator sau 400 μg printr-un distanțier la fiecare oră până la PSV mai mult de 60-70% din datorate, apoi 2,5 mg la fiecare 6 ore (de 4 ori pe zi).
Dacă 20 de minute după ultima inhalare a ventolinei PSV rămâne sub 50% din valoarea cea mai bună sau individuală pentru pacient, repetați inhalarea ventolinei (este posibilă o combinație cu anticolinergice) 2,5 mg printr-un nebulizator sau 400 μg printr-un distanțează la fiecare 20 de minute într-o oră.
Dacă, la 15-20 de minute după ultima inhalare, PSV rămâne sub 50% din valoarea corectă sau cea mai bună pentru pacient, atunci pacientul trebuie internat în secția de terapie intensivă.
Indicațiile pentru transferul pacientului la secția de terapie intensivă sunt:
1. Exacerbarea severă a astmului bronșic (în absența efectului tratamentului efectuat în decurs de 2-3 ore).
2. Exacerbarea periculoasă a vieții astmului bronșic cu dezvoltarea semnelor de stop respirator iminent sau pierderea cunoștinței.
Terapia în unitatea de terapie intensivă:
1. Terapia cu oxigen.
2. Administrarea beta-agoniștilor prin inhalare (la fiecare 4-6 ore).
3. Glucocorticosteroizi pe cale orală (dacă pacientul poate înghiți) sau parenteral.
4. Aminofilină intravenos 5-6 mg / kg la fiecare 10-30 minute (doza este redusă dacă pacientul a luat preparate teofiline înainte de internare), apoi doza este redusă la 0,6-1,0 mg / kg (720 mg / zi, maxim zilnic doza 2 g).
5. Poate introducerea beta-agoniștilor parenterali.
6. Dacă terapia este ineficientă, este indicat suportul respirator.
Indicații pentru ventilația artificială pulmonară (ALV):
1. Obligatoriu - afectarea conștiinței, stop cardiac, aritmii cardiace fatale.
2. Opțional - o creștere a hipercapniei și a acidozei respiratorii (pH mai mic de 7,15), hipoxemie refractară, depresie respiratorie, agitație, oboseală pronunțată a mușchilor respiratori.
Datorită numărului ridicat de complicații și mortalitate a pacienților cu TOA în timpul ventilației mecanice, se recomandă punerea în aplicare a tacticii de hipoventilație controlată (hipercapnie permisivă), sarcina căreia este menținerea strictă a presiunii expiratorii finale a „platoului”, nu mai mare de 30 cm H2O în ciuda deteriorării pH-ului și a dioxidului de carbon Pa. Parametrii inițiali ai suportului respirator ar trebui să fie alegerea unui mod controlat de volum cu un volum mareic de 6-8 ml / kg, o frecvență de ventilație de 6-10 per 1 min, un debit inspirator de 80-100 l / min. Bicarbonat.
Criterii de transfer de la unitatea de terapie intensivă:
1. Ameliorarea completă a stării de astmatic (exacerbarea severă sau care pune viața în pericol a astmului bronșic.
2. Reducerea severității exacerbării astmului bronșic (VAN mai mic de 25 pe minut, ritmul cardiac mai mic de 110 pe minut, PSV mai mare de 250 litri pe minut sau mai mult de 50% din valoarea corectă, oxigen Ra mai mare de 70 mm Hg sau Sa oxigen mai mult de 92%.
Externare din spital.
Pacientului i se vor prescrie medicamentele recomandate la externare cu cel puțin 12 ore (de preferință 24 de ore) înainte ca pacientul să părăsească spitalul.
Procedând astfel, este necesar să ne asigurăm că acest tratament controlează evoluția bolii:
1. Necesitatea de a utiliza beta-agoniști inhalatori cu acțiune scurtă nu mai des decât la fiecare 4 ore.
2. Activitatea fizică normală a pacientului.
3. Pacientul nu se trezește noaptea sau dimineața devreme.
4. Rezultatele examinării clinice sunt normale sau aproape de normal.
5. După administrarea beta-agoniștilor cu acțiune scurtă inhalatori PSV și FEV1, mai mult de 70-80% din valorile corecte sau cele mai bune ale pacientului
6. Dispersia zilnică a PSV este mai mică de 20%. În același timp, trebuie remarcat faptul că, la unii pacienți, valorile PSV pot crește încet la nivelul adecvat (mai ales atunci când vine vorba de dispariția scufundărilor de dimineață), în timp ce toate celelalte criterii confirmă oportunitatea externării.
7. Pacientul știe cum să utilizeze corect dispozitivul de administrare a medicamentului recomandat.
8. Pacientul primește steroizi orali și inhalatori pe lângă bronhodilatatoare.
9. Pacientul înțelege cum să fie tratat după externare.
10. Pacientul are un debitmetru de vârf pe care pacientul știe să îl folosească.
11. Pacientul are un plan de acțiune scris pentru o exacerbare a astmului.
După externarea din spital, pacientul trebuie să fie sub supravegherea unui terapeut local sau pneumolog timp de 4-6 săptămâni.
Astfel, diagnosticul modern și terapia exacerbării astmului bronșic includ o evaluare a severității stării pacientului utilizând indicatori de permeabilitate bronșică, numirea beta-agoniștilor 2 și a anticolinergicelor administrate printr-un nebulizator sau printr-un inhalator cu doză măsurată cu un -volum distanțier, în loc de Euphyllin ca agent de primă linie.pentru ameliorarea obstrucției bronșice.
Sperăm că introducerea pe scară largă a acestor metode în practica clinică va crește eficacitatea tratamentului exacerbărilor astmului bronșic.
STARE ASTMATICĂ.
O afecțiune astmatică este o „neobișnuită” în atacul astmatic sever, rezistentă la terapia obișnuită pentru pacientul cu bronhodilatatoare. Formarea acestei rezistențe este asociată cu blocarea funcțională progresivă a receptorilor b-adrenergici. În plus, o tulburare pronunțată a transportului mucociliar are o mare importanță în apariția stării astmatice.
O afecțiune astmatică este un astm bronșic exacerbat prelungit, care se bazează pe procesul de obstrucție bronșică (mucobronchostasis) și pe sindroamele clinice rezultate: respiratorii, hemodinamice și „encefalopatie hipoxică”.
ETIOLOGIA STĂRII ASTMATICE
Printre principalii factori care conduc la dezvoltarea SA se numără: expunerea masivă la alergeni, infecția bronșică sau sinusală, bolile infecțioase, erorile în tratamentul pacienților, stresul psihoemoțional (stresul), influențele meteorologice adverse. În aproape jumătate din cazuri, nu este posibil să se stabilească cauza AS. Mai mult de jumătate din cazurile de SA sunt diagnosticate la pacienții cu astm bronșic dependent de steroizi.
Erorile tactice în terapia medicamentoasă la pacienții cu astm bronșic în aproape 70% din cazuri devin motivele dezvoltării AS. Retragerea nejustificată sau rapidă a medicamentelor cu glucocorticosteroizi este cauza SA în 17-24% din cazuri.
De asemenea, în 16,5-52,3% din observații, dezvoltarea AS este facilitată de utilizarea necontrolată a simpatomimeticelor inhalate. Sindromul „rebound” observat și bine studiat se caracterizează printr-o agravare progresivă a atacurilor de astm datorită acțiunii bronhoconstrictoare a metaboliților acumulatori ai agoniștilor beta-adrenergici. Anularea inhalării simpatomimetice împiedică dezvoltarea AS. Cu toate acestea, trebuie remarcat faptul că este necesar să se facă distincția între sindromul „rebound” și deteriorarea stării pacienților din cauza ineficienței terapiei prin inhalare cu simpatomimetice datorită obstrucției bronșice severe sau a manevrei de respirație necorespunzătoare în timpul inhalării. Dezvoltarea statusului astmatic poate fi declanșată și de aportul de medicamente antiinflamatoare nesteroidiene, beta-blocante.
PATOGENEZA STĂRII ASTMATICE
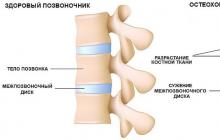
Elementul principal al fiziopatologiei AS este obstrucția bronșică pronunțată cauzată de edemul peretelui bronșic, bronhospasm, afectarea drenajului bronșic și obstrucția bronhiilor cu dopuri mucoase. Toate acestea duc la dificultăți în inhalare, activare și prelungire a expirației, care se înregistrează ca o scădere a VC, FVC, FEV și a debitului expirator de vârf (PSV).
În plus față de obstrucția bronșică severă în patogeneza AS, „supra-umflarea” plămânilor joacă un rol semnificativ. La inspirație, apare o oarecare expansiune a bronhiilor, iar pacientul inspiră mai mult aer decât are timp să expire prin căile respiratorii înguste și obturate, cu o secreție traheobronșică vâscoasă. Încercările pacientului de a expira întregul volum mareic duc la o creștere bruscă a presiunii intrapleurale și la dezvoltarea fenomenului de colaps expirator al bronhiilor mici, ducând la o retenție excesivă a aerului în plămâni. În același timp, hipoxemia arterială progresează, crește rezistența vasculară pulmonară, apar semne de insuficiență ventriculară dreaptă și indicele cardiac scade brusc. În plus, sindromul de oboseală al mușchilor respiratori se dezvoltă datorită muncii uriașe, dar ineficiente a mușchilor respiratori. Prețul oxigenului respirației crește, se dezvoltă acidoză metabolică.
Hipoxemia arterială, care însoțește AS în aproape 100% din cazuri, este, de asemenea, asociată cu o neomogenitate pronunțată a zonelor parenchimului pulmonar și o încălcare accentuată a relațiilor de ventilație-perfuzie.
Hipercapnia se observă și în AS, dar într-un număr semnificativ mai mic de cazuri, ca urmare a scăderii ventilației alveolare datorită obstrucției bronșice și oboselii mușchilor respiratori. Acidoza respiratorie cauzată de hipercapnie este adesea însoțită de alcaloză metabolică, dar dezvoltarea acidozei metabolice este uneori observată din cauza hipoxiei tisulare prelungite și a activității respiratorii crescute.
AS este însoțit destul de des de tulburări hemodinamice ale pacienților. Acest lucru este asociat cu o creștere semnificativă a presiunii intratoracice, deosebit de pronunțată la expirare, precum și „supra-umflarea” plămânilor, ceea ce duce la o scădere a umplerii diastolice a atriilor și a inimii drepte, colapsul venei cave inferioare. Pe de altă parte, există fenomenul de proeminență a septului interventricular în inima stângă și o scădere a umplerii diastolice a ventriculului stâng. În plus, cu AS, există o negativitate pronunțată a presiunii intrapleurale în timpul inspirației, ceea ce duce la o creștere a postîncărcării ventriculare stângi și la dezvoltarea așa-numitului puls "paradoxal" al fluctuațiilor semnificative ale valorii tensiunii arteriale sistolice în faze de inspirație și expirație. O scădere a pulsului „paradoxal” indică fie o scădere a obstrucției bronșice, fie prezența oboselii pronunțate a mușchilor respiratori și imposibilitatea unei scăderi semnificative a presiunii intrapleurale în timpul inspirației. Hiperventilația plămânilor, împreună cu transpirația crescută, în AS duce adesea la dezvoltarea hipovolemiei și îngroșarea sângelui.
IMAGINE CLINICĂ
Cursul clinic al SA este împărțit în trei etape (Chuchalin, 1985).
Etapa I (compensare relativă) se caracterizează prin dezvoltarea unui atac de sufocare care nu ameliorează pe termen lung. Pacienții sunt conștienți, adecvați. Respirația scurtă, cianoza, transpirația sunt moderat pronunțate. Percuție - sunet pulmonar cu o umbră de cutie, auscultator - respirație slăbită, efectuată în toate departamentele, raliuri împrăștiate uscate. În acest stadiu, se observă cel mai adesea hiperventilație, hipocapnie și hipoxemie moderată. FEV este redus la 30% din valoarea datorată. Cel mai alarmant simptom este lipsa producției de spută.
Stadiul II (decompensare sau „plămân tăcut”) se caracterizează printr-o afecțiune severă, o creștere suplimentară a obstrucției bronșice (FEV,< 20% от должной величины), гипервентиляция сменяется гиповентиляцией, усугубляется гипоксемия, появляются гиперкапния и респираторный ацидоз. Аускультативно выслушиваются зоны "немого" легкого при сохранении дистанционных хрипов. Больной не может сказать ни одной фразы, не переводя дыхания. Грудная клетка эмфизематозно вздута, экскурсия ее почти незаметна. Пульс слабый, до 140 в мин, часто встречаются аритмии, гипотония.
Stadiul III (comă hipoxicapnică hipoxică) se caracterizează printr-o afecțiune extrem de gravă, tulburări cerebrale și neurologice. Respirația este rară, superficială. Impuls asemănător firului, hipotensiune, colaps.
Fenomenul auscultator al „plămânului tăcut”. Progresia acidozei respiratorii sau metabolice în timpul tratamentului. Cu toate acestea, la pacienții aflați în stare gravă, semnele clinice nu sunt ușor de evaluat în dinamică, prin urmare, în prezent, la pacienții cu SA, principala metodă care permite acest lucru să se facă ușor și rapid este debitmetria de vârf. Starea extremă a pacientului este evidențiată de: valoarea PSV mai mică de 120 l / min, imposibilitatea efectuării manevrei de debit de vârf sau absența dinamicii pozitive ca urmare a tratamentului.
A.G. Chuchalin (1985) distinge două forme de AS: anafilactic și metabolic.
Forma anafilactică a SA se caracterizează prin apariția rapidă și creșterea obstrucției bronșice (în principal datorată bronhospasmului), simptomele clinice ale SA și progresia hipoxemiei arteriale. În esență, această formă de AS este o reacție alergică de tip reagin la diferiți factori exogeni. De regulă, această formă de SA se dezvoltă ca urmare a utilizării medicamentelor la care pacientul are o sensibilitate crescută (antibiotice, sulfonamide, medicamente proteice, antiinflamatoare nesteroidiene, dextrani, enzime etc.). În plus, această formă de UA apare atunci când respirați aer cu miros de vopsea și parfum, precum și cu traume mentale. Mult mai puțin frecventă este forma metabolică a SA, care se caracterizează printr-o dezvoltare treptată (pe parcursul mai multor zile) a simptomelor clinice ale SA, o scădere a volumului activității fizice. Cel mai adesea, dezvoltarea acestei forme de SA este cauzată de: utilizarea necontrolată de medicamente, în special glucocorticosteroizi, sedative și antihistaminice, exacerbarea infecției bronșice. Această formă de SA se caracterizează prin rezistență la bronhospasmolitice.
Decesul pacienților cu SA apare ca urmare a obstrucției bronșice progresive, cu eșecul măsurilor terapeutice, precum și datorită tulburărilor hemodinamice severe, stopului cardiac sau ca urmare a pneumotoraxului. În plus, greșelile tactice ale medicilor duc adesea la moarte: prescripția tardivă și insuficientă a medicamentelor corticosteroide, supradozajul cu teofilină, glicozide, adrenomimetice, sedative, administrare excesivă de lichide, bronhospasm crescut în timpul bronhoscopiei de igienizare, progresia infecției bronhopulmonare pe fundalul ventilației mecanice .
Cauzele morții în starea astmatică:
1. Stare astmatică progresivă, care nu este supusă terapiei
2. Terapie inadecvată: utilizare insuficientă, de exemplu, insuficientă a steroizilor
prea masiv, de exemplu, o supradoză de izadrin, teofilină
3. Utilizarea sedativelor sau drogurilor
4. Patologie pulmonară asociată: infecție pneumotorax aspirație a vărsăturilor
5. Ventilație mecanică inadecvată sau defecțiune a ventilatorului
6. Tulburări hemodinamice:
- hipovolemie, șoc
- edem pulmonar
- hipervolemie
- presiune pleurală negativă
7. Stop cardiac brusc
Tulburări legate de starea astmatică
VOLUM VASCULAR INTERN
Hipovolemia cu scăderea volumului de sânge cu 10% este o afecțiune frecventă la pacienții cu stare de astmatic. Aceasta este însoțită de o creștere a hematocritului și a concentrației proteinelor plasmatice din sânge. Motivul acestei scăderi aparente a volumului plasmatic nu este clar. O scădere a volumului intravascular poate predispune la colapsul circulator.
De asemenea, a fost descrisă apariția hipervolemiei; la unii pacienți cu stare de astmatic, crește formarea hormonului antidiuretic. Astfel, se pot dezvolta intoxicații cu apă și hipernatremie, care ar trebui luate în considerare ca posibil motiv pentru o modificare a stării pacientului.
EDEM PULMONAR
O creștere a cantității de lichid din plămâni duce la obstrucționarea în continuare a bronhiilor mici în starea de astmatic și afectează schimbul de gaze. În plus față de hipervolemie, edemul pulmonar poate fi indus prin ventilație mecanică. Tendința de a închide bronhiile mici crește FRU și tracțiunea elastică a țesutului pulmonar. Valoarea presiunii intrapleurale este astfel mai negativă la inspirație și încet devine pozitivă la expirare numai în timpul obstrucției bronșice severe. Într-unul dintre studii, s-a arătat că presiunea intrapleurală în timpul inspirației și expirației la copiii cu status astmaticus variază de la -7,7 la -25,5 cm coloană de apă cu o rată de 5 cm coloană de apă. O scădere a presiunii intrapleurale reduce, de asemenea, tracțiunea elastică a țesuturilor plămâni, care favorizează pătrunderea lichidului edematos în plămâni.
INSUFICIENȚA ADRENALĂ
Toți pacienții cu astm bronșic care au fost tratați cu hormoni în trecut ar trebui să primească corticosteroizi în mod sistematic în stare astmatică, deoarece funcția glandelor suprarenale poate fi redusă drastic sau absentă cu totul.
SISTEM NERVOS CENTRAL
Dacă simptomele stării de astmatic progresează, pacientul devine iritabil, conștiința sa este confuză. El poate deveni indiferent, până la „dezvoltarea unei comă. Motivul pentru acest lucru este neclar. Factorii care afectează starea sistemului nervos central pot fi hipercapnia și hipoxemia, slăbiciunea, efectul măsurilor terapeutice și, eventual, poate fi importantă și intoxicația cu apă. Conștiința afectată a pacientului este un semn formidabil, nu numai că reflectă severitatea stării pacientului, ci și face imposibilă terapia adecvată.
TULBURĂRI METABOLICE
Acidoza metabolică se dezvoltă întotdeauna în stare astmatică ca urmare a creșterii conținutului de acizi lactici și piruvici din sânge. O creștere a intensității glicolizei și a glicolizei anaerobe în mușchii respiratori în perioada de obstrucție extremă a căilor respiratorii poate provoca, de asemenea, o schimbare a echilibrului acido-bazic în partea acidă.
La pacienții cu stare de astmatic, activitatea aspartatului aminotransferazei, lactatului dehidrogenazei și a creatin fosfokinazei din serul sanguin este semnificativ crescută. Concentrația ionilor Mq și K + în serul sanguin rămâne normală. Principala variabilă din serul sanguin este 2,3-di-fosfogliceratul, a cărui concentrație crește la 17,5 μmol / g Hb ", cu limita superioară a normei la 16 μmol / g Hb; posibil, acesta este un mecanism compensator pentru creșterea livrării de oxigen.la țesuturi în timpul stării astmatice.
DIAGNOSTIC DIFERENTIAT
Un pacient care se plânge de respirație scurtă și respirație șuierătoare, împreună cu o detectare obiectivă a respirației șuierătoare expiratorii și inspirație limitată, este atât de sigur diagnosticat cu un atac acut de astm bronșic, încât, din păcate, uită de alte boli care ar putea da simptome similare.
OBSTRUCȚIE SUPERIORĂ AERWAY
Obstrucția traheală intratoracică determină predominant respirația șuierătoare, care nu se distinge de respirația șuierătoare în bronhospasm. O astfel de obstrucție traheală se poate datora stenozei traheale, unei artere pulmonare aberante sau unui corp străin. Diagnosticul este ajutat de clarificarea debutului bolii, dar poate fi confirmat doar cu bronhoscopie.
Deși obstrucția extratoracică a traheei sau laringelui provoacă în mod predominant dificultăți de respirație, ele pot simula astmul bronșic. Am observat obstrucția cauzată de o pilulă mare introdusă în gura unui pacient în vârstă, considerată „bronhospasm” și tratată cu o perfuzie intravenoasă de aminofilină.
EMBOLIA PULMONARĂ
Scăderea respirației și respirația șuierătoare expiratorie pot apărea în cazul emboliei pulmonare. Diagnosticul diferențial necesită de obicei angiografie pulmonară. Scanarea va arăta modificări în ambele procese.
EDEM PULMONAR
Edemul pulmonar este adesea însoțit de umflarea spațiilor peribronșice și apariția șuierătorului expirator. Edemul poate fi asociat cu creșterea presiunii ventriculare stângi și poate necesita cateterizarea arterei pulmonare cu un cateter cu balon plutitor pentru diagnostic. Edemul pulmonar la presiune normală este dificil de diagnosticat, dar poate fi suspectat la examenul clinic.
INFECȚIA PULMONARĂ
Bronșita acută sau bronșiolita pot simula astmul bronșic. Examinarea sputei cu colorare Gram poate ajuta la stabilirea unui diagnostic. Studiul leucocitelor este inutil, leucocitoza este adesea observată în absența infecției pulmonare.
Ruptura pulmonara
Aerul din interstițiul plămânilor sau din mediastin poate comprima căile respiratorii, simulând un spasm al mușchilor netezi ai bronhiilor. Șuieratul expirator poate apărea și în cazul pneumotoraxului.
SPRIJINIRE GASTRICĂ
Respirația scurtă și respirația șuierătoare poate fi cauzată de aspirația conținutului gastric. În același timp, modificările caracteristice și diagnosticul nu sunt vizibile pe radiografia toracică; pus prin metoda eliminării.
MEDICAMENTE
Medicamentele pot provoca un tablou clinic identic cu tabloul clinic în astmul bronșic, datorită hipersensibilității la acestea sau direct.
Principii și metode de tratament pentru SA
Tratamentul AS este de obicei medicament. Dacă terapia conservatoare eșuează, ventilația mecanică este metoda de alegere. Severitatea și rapiditatea dezvoltării simptomelor clinice ale SA determină necesitatea de a oferi asistență pacienților din unitățile de terapie intensivă sau unitățile de terapie intensivă.
Principiile principale ale terapiei AS sunt: terapia bronhodilatatoare puternică, inițierea imediată a administrării glucocorticosteroizilor, tratamentul prompt, ușurința procedurilor pentru pacient, corectarea tulburărilor secundare ale schimbului de gaze, starea acido-bazică, hemodinamica etc.
Glucocorticosteroizii sunt medicamentul numărul unu pentru SA. Sunt capabili să elimine blocada funcțională a receptorilor beta-adrenergici. Introducerea acestor medicamente trebuie începută imediat, cu toate acestea, terapia cu glucocorticosteroizi nu trebuie considerată monoterapie, deoarece efectul acestor medicamente atunci când este administrat intravenos nu trebuie așteptat mai devreme de 1-2 ore mai târziu. Doza uzuală de hidrocortizon pentru AS este de 600-1200 mg / zi.
Terapia cu glucocorticosteroizi reg os se efectuează cu o rată de 0,5 mg / kg de prednisolon, urmată de o reducere progresivă a dozei. Dacă medicamentele hormonale sunt injectate într-o doză suficientă, restabiliți efectul de arestare al simpatomimeticelor.
În cazul unei afecțiuni extrem de grave a pacienților cauzată de o obstrucție bronșică generalizată în creștere rapidă, cu o eficacitate scăzută a măsurilor terapeutice, este indicat un curs de terapie cu puls cu metilprednisolonă (1000 mg). Experiența utilizării terapiei cu puls în AS mărturisește fără echivoc eficiența ridicată a acestei metode de tratare a acestei categorii de pacienți.
Teofilina rămâne un medicament care este adesea utilizat în AS. Doza inițială de aminofilină este de 5-6 mg / kg; în viitor, este recomandabil să o reduceți la 0,6-1,0 mg / kg. Doza zilnică maximă de aminofilină este de 2 g. Utilizarea preparatelor de teofilină necesită o monitorizare constantă a activității cardiace datorită tahicardiei și aritmiilor destul de frecvente. Au fost descrise fatalitățile asociate cu utilizarea preparatelor de teofilină în AS.
Când sensibilitatea receptorilor beta-adrenergici este restabilită, este posibilă conectarea agoniștilor beta-2-adrenergici la terapie. De obicei se administrează prin inhalare. Utilizarea agoniștilor beta-2-adrenergici sub formă de inhalare a unui aerosol obținut utilizând nebulizatoare (nebulizatoare) de diferite modificări, care sunt capabile să genereze aerosoli cu dimensiunea particulelor de 0,5-5 microni, are perspective mari. În acest caz, se realizează prelungirea inhalării, se elimină necesitatea sincronizării obligatorii a inhalării și pulverizării cu aerosoli, se umidizează căile respiratorii ale pacienților și, ca o consecință a tuturor acestor lucruri, se constată realizarea bronhodilatației eficiente.
Cu forma anafilactică de AS, este indicată administrarea unei soluții de adrenalină. De obicei se administrează subcutanat. Unii cercetători preferă să injecteze soluție de adrenalină intravenos cu AS la o rată de 0,1 mg / kg / min. Cu toate acestea, această terapie este însoțită de numeroase efecte secundare și se efectuează în caz de eșec al tratamentului sau în prezența colapsului.
În prezența semnelor de infecție bronșică și absența reacțiilor alergice, se prescrie terapia cu antibiotice.
Terapia cu oxigen este de obicei indicată pentru SA în caz de hipoxemie arterială (PaO2 mai mică de 60 mm Hg). Când se efectuează cu un conținut de oxigen mai mic de 30%, de regulă, nu se observă nicio creștere a hipercapniei. Terapia cu oxigen se efectuează folosind o canulă nazală sau o mască Venturi la o rată de 1-5 L / min. Gasometria arterială a sângelui este monitorizată la 20-30 de minute după începerea terapiei cu oxigen, care este considerată eficientă dacă este posibil să se mențină un nivel de PaO2 mai mare de 80 mm Hg. Artă. și SatO2, peste 90%.
Ventilația pulmonară asistată (IVL) este indicată în cazul persistenței hipoxemiei arteriale, progresia hipercapniei arteriale la pacienții cu oxigenoterapie, precum și a oboselii severe a mușchilor respiratori. Sarcina principală a IVL este de a câștiga timp pentru terapia medicamentoasă masivă menită să elimine obstrucția bronșică, fără a suprima respirația spontană a pacientului. IVL se efectuează atât în modul de declanșare, cât și în modul de adaptare, folosind măști pentru față sau nas. Pentru a preveni colapsul expirator al bronhiilor mici, precum și pentru a reduce consumul excesiv de energie al respirației la pacienții cu un nivel ridicat de presiune pozitivă spontană la sfârșitul expirației, se recomandă utilizarea presiunii pozitive externe în timpul expirației în intervalul 5-9. cm de apă. Artă. sub controlul parametrilor hemodinamici.
Indicațiile pentru transferul pacientului la ventilație artificială pulmonară (ALV) cu AS sunt:
Obligatoriu:
1. Încălcarea conștiinței;
2. Stop cardiac;
3. Aritmii fatale ale inimii.
Opțional:
4. Acidoza progresivă (pH< 7,2);
5. Hipercapnie progresivă;
6. Hipoxemie refractară;
7. Depresie respiratorie;
8. Excitație;
9. Oboseală severă a mușchilor respiratori.
Principala problemă care apare în timpul ventilației mecanice la pacienții cu SA este prevenirea unei creșteri a „supra-umflării” plămânilor. În acest scop, se recomandă să respectați următoarele tactici: efectuați ventilație mecanică, prevenind dezvoltarea presiunii ridicate în căile respiratorii (mai puțin de 35 cm de apă), frecvența de ventilație nu trebuie să depășească 6-10 pe minut, maree volum - 6-8 ml / kg. Acest lucru duce inevitabil la o scădere a ventilației alveolare minute și la o creștere a hipercapniei (hipercapnie permisivă sau permisă). Un nivel adecvat de PaO2 este menținut prin creșterea conținutului de oxigen din amestecul inhalat la mai mult de 60%, o scădere a pH-ului sângelui arterial sub 7,2 este corectată prin administrarea de bicarbonat de sodiu. Strategia de hipoventilație controlată permite asigurarea unui nivel adecvat de oxigenare a sângelui arterial, reducând în același timp riscul de barotraumatism pulmonar și incidența complicațiilor hemodinamice ale ventilației mecanice, care se găsesc adesea la pacienții cu SA.
Analiza cauzelor și tiparelor de dezvoltare a AS sugerează că evoluția sa depinde în mare măsură de comportamentul medicului.
Diagnosticul precoce, terapia rațională rapidă asigură prevenirea fiabilă a progresiei AS, în etapele ulterioare ale cărora devine eficacitatea tratamentului dubios.
Pentru citare: Nenasheva N.M. Exacerbarea astmului bronșic: tratament și prevenire // BC. 2013. Nr. 29. S. 1490
Astmul bronșic (BA) este o boală caracterizată printr-un curs variabil. Exacerbările astmului bronșic nu sunt neobișnuite în viața pacienților care suferă de această boală.
Definiția conceptului
și severitatea exacerbării astmului
Conform definiției GINA, exacerbarea astmului (astm acut) reprezintă episoade de manifestări pronunțate ale astmului: creșterea dificultății de respirație, tuse, respirație șuierătoare, congestie toracică sau orice combinație a acestor simptome. Se pot dezvolta tulburări respiratorii și insuficiență respiratorie acută. Exacerbarea BA se caracterizează printr-o scădere a debitului volumetric al aerului expirat, care poate fi determinată prin examinarea funcției pulmonare pentru a reduce debitul expirator de vârf (PSV) sau volumul expirator forțat în 1 s (FEV1). Într-un document comun al European Respiratory Society (ERS) și American Thoracic Society (ATS), dedicat definirii controlului și exacerbărilor astmului în studiile clinice și practica clinică reală, se propune să se facă distincția între exacerbările severe și moderate ale astm.
Exacerbarea severă este definită ca un eveniment care necesită acțiune imediată de la un medic în legătură cu un pacient pentru a preveni dezvoltarea insuficienței respiratorii acute și a decesului. Exacerbarea severă implică utilizarea glucocorticosteroizilor sistemici (GCS) (forme orale sau parenterale) sau o creștere a dozei de întreținere a GCS timp de cel puțin 3 zile și / sau spitalizare sau solicitarea ajutorului de urgență pentru numirea GCS sistemică.
Exacerbarea moderată a astmului este definită ca un eveniment care provoacă anxietate pacientului și necesită o schimbare a terapiei, dar nu este severă. Cu o exacerbare moderată, există o creștere a simptomelor, incl. nocturnă, funcție pulmonară scăzută, nevoie crescută de β2-agoniști cu acțiune scurtă. Aceste modificări ar trebui să dureze cel puțin 2 zile sau mai mult, dar să nu fie atât de pronunțate încât să necesite numirea corticosteroizilor sistemici și / sau spitalizarea.
Nu se recomandă utilizarea termenului „agravare ușoară”, deoarece este dificil să-l separe de starea de pierdere temporară a controlului AD, care este o reflectare comună a variabilității cursului AD. Trebuie să spun că aceste recomandări se aplică în primul rând studiilor clinice. În practica clinică normală, severitatea unei exacerbări este determinată de severitatea simptomelor (dispnee), datele examenului fizic (frecvența respiratorie (RR), pulsul, imaginea auscultatorie, prezența unui puls paradoxal), rezultatele măsurătorilor PSV, arteriale tensiunea oxigenului (PaO2) și / sau tensiunea dioxidului de carbon în sângele arterial (PaCO2), gradul de saturație a hemoglobinei din sângele arterial cu oxigen, saturația oxigenului (SpO2) (Tabelul 1). Mai jos sunt criteriile pentru exacerbările severe și care pun viața în pericol ale astmului, conform Acordului britanic privind tratamentul astmului.
Criterii pentru exacerbarea severă a astmului:
... PSV 33-50% dintre cele mai bune sau cele datorate;
... RR ≥25 / min;
... HR (ritm cardiac) ≥110 / min;
... vorbire întreruptă.
Criterii pentru o exacerbare care pune viața în pericol la un pacient cu astm sever:
... PSV<33% от лучшего или должного;
... SpO2<92%;
... PaO2<8 kPa;
... Viteza PaCO2 (4,6-6,0 kPa);
... Plămân mut;
... cianoză;
... slăbiciune a mușchilor respiratori;
... aritmie;
... epuizare, afectarea conștiinței.
Rata de dezvoltare a unei exacerbări a astmului poate varia semnificativ la diferiți pacienți - de la câteva minute sau ore până la 2 săptămâni, precum și timpul de rezolvare a exacerbării - de la 5 la 14 zile. Exacerbările astmului se pot dezvolta la orice pacient, indiferent de gravitatea bolii, dar sunt considerate o manifestare clinică frecventă la pacienții cu astm dificil de controlat. În cursul unui program de cercetare pentru studiul astmului sever în SUA, s-a demonstrat că pacienții cu astm sever sunt mult mai predispuși să dezvolte exacerbări care necesită spitalizare, incl. în unitatea de terapie intensivă, precum și numirea ventilației mecanice a plămânilor, comparativ cu pacienții cu BA ușoară și moderată (Fig. 1). Frecvența anuală a exacerbărilor severe ale astmului bronșic la pacienții cu astm ușor, moderat și sever a fost de 5, 13, 54%, iar exacerbările aproape de fatal - 4, 6, 23%, respectiv. În același timp, din numărul total de spitalizări pentru exacerbarea astmului, 30-40% sunt reprezentate de pacienții cu o formă ușoară a bolii.
Infecțiile virale respiratorii ocupă primul loc printre cauzele exacerbărilor astmului. Se știe că 85% din exacerbările BA la copii și 60% la adulți sunt cauzate de virusuri respiratorii, în principal rinovirusuri. În plus, expunerea la un alergen, în special un contact masiv, provoacă, de asemenea, o exacerbare a astmului, iar combinația acestor doi factori declanșatori crește riscul unei exacerbări de mai multe ori (OR 8,4; IC 95%, 2.1-32.8).
Tratamentul exacerbării BA la adulți
Pacienții cu risc crescut de a dezvolta exacerbări severe, fatale ale astmului ar trebui să solicite imediat asistență medicală la semnele inițiale ale unei exacerbări în curs de dezvoltare. Acest grup include următorii pacienți:
- având un istoric de exacerbări ale astmului care pun viața în pericol și care necesită intubație și ventilație artificială;
- internat sau care solicită ajutor de urgență pentru o exacerbare a astmului în ultimul an;
- primesc în mod constant sau anulează recent corticosteroizi orali;
- neprimirea corticosteroizilor inhalatori (ICS);
- cu mare nevoie de β-agoniști cu acțiune scurtă (CDBA) (> 1 inhalator / lună);
- cu boli mintale sau probleme psihosociale (utilizarea sedativelor și a stupefiantelor);
- cu aderență redusă la tratament și care nu îndeplinește prescripția medicului;
- fumători;
- sensibilizat la Alternaria spp.
Severitatea exacerbării determină strategia și sfera terapiei. Pacienții cu exacerbări ușoare până la moderate pot fi tratați în ambulatoriu. Pacienții cu exacerbări severe trebuie tratați într-un spital în terapie intensivă. Tabelul 2 prezintă principalele opțiuni terapeutice și medicamente pentru tratamentul exacerbărilor astmului, conform recomandărilor GINA și British Thoracic Society.
Dozele mari de β2-agoniști inhalatori sunt prima linie de terapie pentru exacerbarea astmului bronșic și trebuie prescrise cât mai devreme posibil! (Nivelul dovezilor A.)
Cu o exacerbare a astmului, în fiecare caz, este necesară o revizuire a terapiei de bază anti-astm a pacientului și o analiză a cauzelor exacerbării dezvoltate.
Indicații pentru trimiterea pacientului la unitatea de terapie intensivă și tratament de urgență:
1) necesitatea suportului de ventilație;
2) în caz de exacerbare severă sau care pune viața în pericol și lipsa de răspuns la terapia în curs, manifestată prin:
- deteriorarea PSV;
- persistenta sau agravarea hipoxiei;
- hipercapnie;
- un studiu al gazelor din sânge care arată pH sau ↓ H +;
- epuizare, respirație slabă;
- somnolență, confuzie, alterare a conștiinței;
- Stop respirator.
Terapia cu doze mari de ICS, utilizată cu un nebulizator, în special cu budesonidă 2 sau 4 mg / zi pentru 4 doze, a fost la fel de eficientă ca terapia cu corticosteroizi orali (prednison 40 mg / zi). Această strategie de tratament de exacerbare a fost studiată în principal la copii, totuși, într-un studiu la adulți, s-a dovedit, de asemenea, că este eficientă în ameliorarea exacerbărilor astmului cu severitate variabilă. Utilizarea unei suspensii de budesonidă (2 mg de 2 ori / zi) printr-un nebulizator timp de 5 zile a fost comparată cu terapia tradițională de exacerbare a astmului cu prednisolon de 15 mg de 2 ori / zi la pacienții adulți. Rezultatele au arătat că ambele strategii pentru tratarea exacerbării astmului au fost eficiente în ameliorarea simptomelor de exacerbare și restabilirea funcției pulmonare. Cu toate acestea, sunt necesare, fără îndoială, studii suplimentare multicentrice pentru a confirma eficacitatea strategiei de utilizare a dozelor mari de ICS în tratamentul exacerbărilor astmului.
Prevenirea exacerbărilor astmului
Obiectivele terapiei AD sunt atingerea și menținerea controlului bolii, determinat de simptomele diurne minime (nu mai mult de 2 cazuri pe săptămână) și de necesitatea medicamentelor pentru a le atenua, absența simptomelor nocturne și limitarea activității pacientului , precum și funcția pulmonară normală. Reducerea riscului de exacerbări, reducerea funcției pulmonare și dezvoltarea efectelor secundare nedorite ale medicamentelor (Fig. 2) sunt printre componentele importante ale controlului general al astmului (Fig. 2).
ICS este cel mai eficient grup de medicamente farmacologice în realizarea controlului și prevenirii exacerbărilor BA atât la copii, cât și la adulți. Sunt deosebit de eficiente în inflamația eozinofilă, iar titrarea dozei ICS în conformitate cu nivelul eozinofilelor din sputa indusă conduce la un control stabil și la o scădere a numărului de exacerbări ale astmului bronșic în comparație cu strategia tradițională bazată pe monitorizarea simptomelor și a plămânilor. funcţie. Cu toate acestea, monoterapia cu ICS nu este eficientă la toți pacienții în realizarea controlului AD, deoarece în practica clinică de rutină, există multe motive pentru un răspuns redus la ICS (Tabelul 3).
După cum se poate vedea din Tabelul 3, în majoritatea cazurilor, β2-agoniștii cu acțiune îndelungată (LABA) ajută la optimizarea răspunsului la ICS. ICS și LABA prezintă un efect complementar. ICS măresc expresia genei receptorului β2-adrenergic, activând astfel sinteza acestor receptori și crescând expresia acestora pe membrana celulară; în plus, ICS previne desensibilizarea receptorilor β2-adrenergici. În același timp, LABA activează receptori GCS inactivi, făcându-i mai sensibili la activarea dependentă de steroizi.
Eficacitatea clinică a medicamentelor combinate ICS / LABA se manifestă prin obținerea controlului la un număr mai mare de pacienți și o scădere semnificativă a numărului de exacerbări severe ale astmului, ceea ce a fost remarcat pentru prima dată în studiul FACET. A arătat că adăugarea de formoterol atât la doze mici, cât și la doze mari de budesonid duce la o scădere semnificativă a numărului de exacerbări ale astmului la un pacient pe an (Fig. 3).
Acest efect a fost demonstrat în numeroase studii care au examinat diferite combinații de ICS și LABA. Sinergismul acțiunii ICS și LABA se manifestă în raport cu o scădere a inflamației eozinofile, prevenirea bronhospasmului și inhibarea remodelării peretelui bronșic, ceea ce duce în cele din urmă la controlul eficient al astmului și la scăderea riscului de exacerbări.
Pentru medicamentul combinat BUD / FOR (Symbicort®), se utilizează strategia de tratament cu un singur inhalator, a cărui esență este utilizarea medicamentului atât pentru controlul pe termen lung ca terapie de bază, cât și pentru ameliorarea celor emergente simptome de astm, care sunt posibile datorită debutului rapid al efectului bronhodilatator al formoterolului (în decurs de 1-3 minute). În plus, formoterolul se caracterizează printr-un efect bronhodilatator dependent de doză, spre deosebire de salmeterol. Rațiunea strategiei unui singur inhalator, pe lângă efectele formoterolului, este efectul antiinflamator suplimentar al ICS inhalat simultan cu formoterolul pentru ameliorarea simptomelor, care, așa cum era de așteptat, se manifestă printr-un efect clinic suplimentar - o scădere în incidența exacerbărilor astmului.
Această strategie a fost studiată în mai multe studii clinice comparative randomizate, care au demonstrat că utilizarea EUD / FOR într-un singur mod inhalator reduce incidența exacerbărilor severe ale astmului care necesită spitalizare și administrarea de corticosteroizi sistemici, reduce simptomele astmului și îmbunătățește funcția pulmonară. în comparație cu terapia de 4 ori. doza de budesonidă sau utilizarea BUD / FOR pentru terapia de întreținere și CBAA pentru ameliorarea simptomelor. Acest efect a fost observat la pacienții cu astm sever și moderat, care nu au fost controlați de doze medii de ICS sau de combinația lor cu LABA, care au avut, de asemenea, un istoric de exacerbări severe ale astmului.
În prezent, mecanismul acțiunii preventive a strategiei cu inhalator unic în legătură cu exacerbările astmului nu este pe deplin înțeles. Aparent, o creștere a dozei ICS simultan cu inhalări suplimentare de LABA în perioada primelor semne de exacerbare a astmului (creșterea simptomelor astmului durează de obicei 5-7 zile) poate preveni o exacerbare suplimentară, cu condiția ca pacientul să simtă și să evalueze în mod adecvat aceste simptome. O analiză retrospectivă a 5 mari studii clinice randomizate (> 12 mii de pacienți) a eficacității comparative a EUD / FOR, utilizate într-un singur mod de inhalare, și a diferitelor scheme de terapie tradiționale au arătat avantajele acestei strategii în toate etapele terapiei (conform GINA) în ceea ce privește reducerea numărului de exacerbări severe ale astmului (fig. 4).
S-a menționat deja mai sus că cea mai frecventă cauză a exacerbărilor BA la adulți și copii este infecțiile respiratorii virale, care deseori duc la pierderea controlului și la dezvoltarea exacerbării chiar și la pacienții cu astm bine controlat. O scădere a riscului de dezvoltare a acestora a fost arătată pe fondul terapiei ICS / LABA comparativ cu monoterapia ICS, care indică încă o dată un efect antiinflamator pronunțat al medicamentelor combinate. Cursul variabil al AD necesită adesea un răspuns rapid la apariția simptomelor unei exacerbări incipiente a bolii și, în acest sens, utilizarea ICS „la cerere” (când apar simptomele) după sau simultan cu CBAA sau LABA (formoterol ) este o strategie promițătoare.
Un studiu analitic retrospectiv amplu a investigat relația infecțiilor respiratorii (răceli) și a exacerbărilor severe ale astmului bronșic la 12 507 pacienți care au participat la 5 studii clinice mari randomizate, dublu-orb, care au evaluat strategia utilizării BUD / FOR într-un singur mod inhalator. în comparație cu alte regimuri de terapie (ICS / LABA în doze fixe sau mai mari + CBAA sau formoterol, după cum este necesar). Exacerbările severe ale astmului au fost considerate exacerbări care au necesitat numirea GCS sistemică timp de 3 sau mai multe zile și / sau spitalizare sau căutarea ajutorului de urgență. O exacerbare a astmului asociată cu infecția respiratorie acută (ARI) a fost considerată o exacerbare care s-a dezvoltat în decurs de 14 zile de la debutul unei răceli.
Așa cum era de așteptat, rezultatele analizei au arătat că incidența ARI nu a diferit între pacienții cărora li s-au administrat diferite regimuri de terapie anti-astm cu ICS / LABA (20-22% dintre pacienți pe an de urmărire). Creșterea frecvenței ARI a fost observată în perioada de toamnă-iarnă, durata medie a ARI a fost de 7 zile. Frecvența exacerbărilor severe ale astmului a fost semnificativ mai mică în rândul pacienților care au primit BUD / FOR într-un singur mod de inhalare, comparativ cu alte strategii + CBAA (9-13 și respectiv 12-22%). În perioada ARI, avantajul BUD / FOR în regimul cu inhalator unic a fost remarcat în ceea ce privește reducerea riscului de exacerbări ale BA cu 36% față de regimul de terapie de întreținere cu doze fixe de ICS / LABA + CBAA, după cum este necesar (Fig. 5). ). Diferența maximă în frecvența exacerbărilor severe a astmului asociat cu ARI a fost găsită între regimurile unui singur inhalator BUD / FOR (reducerea exacerbărilor cu 52%) și doze fixe echivalente de ICS / LABA + CBAA, care pot indica importanța a unei creșteri în timp util a terapiei antiinflamatorii anti-astm. cu ajutorul unor doze suplimentare de ICS în combinație cu LABA în raport cu prevenirea exacerbării astmului.
Concluzie
Exacerbările astmului se pot dezvolta la orice pacient, indiferent de gravitatea bolii, dar mai des pacienții cu astm sever sau dificil de control suferă de aceștia. Prevenirea exacerbărilor astmului este o componentă importantă a controlului complet și stabil al bolii. ICS este cel mai eficient grup de medicamente farmacologice în realizarea controlului și prevenirii exacerbărilor BA atât la copii, cât și la adulți. Combinația dintre ICS și LABA este mai eficientă atunci când este utilizată în mod regulat la pacienții cu simptome de astm bronșic care nu sunt controlate prin monoterapie cu ICS. Utilizarea BUD / FOR într-un singur mod inhalator s-a dovedit a fi o strategie eficientă în reducerea frecvenței exacerbărilor severe ale astmului, incl. ca urmare a ARI.





Literatură
1. GINA, www.ginasthmaorg.org.
2. Reddel H.K., Taylor D.R., Bateman E.D. și colab. O declarație oficială American Thoracic Society / European Respiratory Society: controlul astmului și exacerbări: standardizarea obiectivelor pentru studiile clinice de astm și practica clinică // Am J Respir Crit Care Med. 2009. Vol. 180. P. 59-99.
3. Ghidul britanic privind gestionarea astmului. Un ghid clinic național. www.brit-thoracic.org.uk.
4. Moore W. C., Bleecker E. R., Curran-Everett D. și colab. Caracterizarea fenotipului de astm sever de către Programul de cercetare a astmului sever al Institutului Național al Inimii, Plămânilor și Sângelui // J Allergy Clin Immunol. 2007. Vol. 119. P. 405-413.
5. Pendergraft T.B., Stanford R.H., Beasley R. și colab. Tarifele și caracteristicile internărilor în unități de terapie intensivă și intubații în rândul spitalizărilor legate de astm // Ann Allergy Asthma Immunol. 2004. Vol. 93. P. 29-35.
6. Johnston S. L., Pattemore P. K., Sanderson G. și colab. Relația dintre infecțiile respiratorii superioare și internările în spital pentru astm: o analiză a tendințelor în timp // Am J Respir Crit Care Med. 1996. Vol. 154. P. 654-660.
7. Johnston S. L., Pattemore P. K., Sanderson G. și colab. Studiu comunitar al rolului infecțiilor virale în exacerbările astmului la copiii de 9-11 ani // BMJ. 1995. Vol. 310. P. 1225-1229.
8. Green R. M., Custovic A., Sanderson G. și colab. Sinergism între alergeni și viruși și riscul internării în spital cu astm: studiu caz-control // BMJ. 2002. Vol. 324. P. 763.
9. FitzGerald J. M., Shragge D., Haddon J. și colab. Un studiu controlat randomizat cu doză mare, budesonidă inhalată versus prednisolon oral la pacienții externați din secția de urgență după o exacerbare acută a astmului // Can Respir J. 2000. Vol. 7.P. 61-67.
10. Volovitz B. Budesonida inhalată în gestionarea agravărilor acute și a exacerbărilor astmului: o revizuire a dovezilor // Respir Med. 2007. Vol. 101 (4). R. 685-695.
11. Chian C.F., Tsai C.L., Wu C.P. și colab. Cursul de cinci zile de suspensie de inhalare a budesonidei este la fel de eficient ca prednisolonul oral în tratamentul exacerbărilor acute de astm ușor până la sever la adulți // Pulm Pharmacol Ther. 2011. Vol. 24 (2). R. 256-260.
12. Bateman E. D., Reddel H. K., Friksson G. și colab. Controlul global al astmului: relația dintre controlul actual și riscul viitor // The Journal of Allergy and Clinical Immunology. 2010. Vol. 125 (3). R. 600-608.
13. Green R. H., Brightling C. E., McKenna S. și colab. Exacerbările astmului și numărul eozinofilelor din spută: un studiu controlat randomizat // Lancet. 2002. Vol. 360.R. 1715-1721.
14. Pauwels R.A., Lofdahl C.G., Postma D.S., Tattersfield A.E., O'Byrne P., Barnes P.J. și colab. Efectul formoterolului inhalat și al budesonidei asupra exacerbărilor astmului. Formoterol și corticosteroizi care stabilesc terapia (FACET) International Study Group // N Engl J Med. 1997. Vol. 337. P. 1405-1411.
15. Bateman E. D., Boushey H. A., Bousquet J. și colab. Poate fi atins controlul astmului definit de ghid? Studiul de obținere a controlului optim al astmului // Am J Respir Crit Care Med. 2004. Vol. 170. P. 836-844.
16. Stanford R.H., Fuhlbrigge A., Riedel A., Rey G.G., Stempel D.A. Un studiu observațional al combinației de doză fixă propionat de fluticazonă / salmeterol sau propionat de fluticazonă singur pe rezultatele legate de astm // Curr Med Res Opin. 2008. Vol. 24. P. 3141-3148.
17. Papi A., Paggiaro P. L., Nicolini G. și colab. Beclometazonă / formoterol versus terapie combinată budesonidă / formoterol în astm // Eur Respir J. 2007. Vol. 29. P. 682-689.
18. O'Byrne P.M., Bisgaard H., Godard P.P. și colab. Terapia combinată budesonidă / formoterol, atât ca tratament de întreținere, cât și ca medicament de eliberare în astm bronșic // Am J Respir Crit Care Med. 2005. Vol. 171.P. 129-136.
19. Rabe K. F., Atienza T., Magyar P. și colab. Efectul budesonidei în asociere cu formoterolul pentru terapia de ameliorare în exacerbările astmului bronșic: un studiu randomizat controlat, dublu-orb // Lancet. 2006. Vol. 368. P. 744-753.
20. Bousquet J., Boulet L.P., Peters M.J. și colab. Budesonid / formoterol pentru întreținere și ameliorare în astmul necontrolat vs. doză mare de salmeterol / fluticazonă // Respir Med. 2007. Vol. 101. P. 2437-2446.
21. Bateman E. D., Harrison T. W., Quirce S. și colab. Controlul global al astmului bronșic realizat cu budesonidă / formoterol de întreținere și terapie de eliberare pentru pacienții aflați în diferite etape de tratament // Respir Res. 2011. Vol. 12, p. 38.
22. Prazma C. M., Kral K. M., Gul N. și colab. Medicamente de control și efectele acestora asupra exacerbărilor astmului asociat temporar cu infecții ale căilor respiratorii superioare // Respir Med. 2010. Vol. 104. P. 780-787.
23. Papi A., Canonica G., Maestrelli P. și colab. Utilizarea de salvare a beclometazonei și a albuterolului într-un singur inhalator pentru astm ușor // N Engl J Med. 2007. Vol. 356. R. 2040-2052.
24. Calhoun W.J., Ameredes B.T., regele T.S. și colab. Compararea strategiilor bazate pe medic, biomarker și simptom pentru ajustarea terapiei cu corticosteroizi inhalatori la adulții cu astm: Procesul controlat randomizat BASALT // JAMA. 2012. Vol. 308 (10). R. 987-997.
25. Papi A., Corradi M., Pigeon-Francisco C. și colab. Beclometazonă-formoterol ca tratament de întreținere și ameliorare la pacienții cu astm: un studiu dublu-orb, controlat randomizat // Lancet Respir Med. 2013. Vol. 1.R. 23-31.
26. Reddel H., Jenkins C., Quirce S. și colab. Efectul diferitelor tratamente pentru astm asupra riscului de exacerbări legate de frig // Eur Respir J. 2011. Vol. 38. P. 584-593.
Exacerbarea astmului bronșic reprezintă episoade de creștere progresivă a dificultății de respirație, tuse, respirație șuierătoare, dificultăți de respirație, opresiune toracică sau o combinație a acestor simptome (GINA, 2006). Motive pentru exacerbare: ARVI, aport de antiinflamatoare nesteroidiene, analgezice, inhibitori ai ECA, inhalarea fumului de tutun și a poluanților, contactul cu un alergen, stresul, boala de reflux gastroesofagian, terapia inadecvată pentru astmul bronșic. Înainte de a începe tratamentul, este necesar să se evalueze severitatea exacerbării.
Tabelul 7. Severitatea exacerbării astmului bronșic
|
Oprirea respirației este inevitabilă |
||||
|
la mers poate minți |
când vorbești preferă să stea |
stând aplecat în față | ||
|
Vorbire (conversație) |
sugestii | |||
|
Nivelul de veghe |
poate fi trezit |
de obicei trezit |
de obicei trezit |
conștiință letargică sau confuză |
|
crescut |
crescut |
adesea> 30 bpm | ||
|
participarea mușchilor accesori la respirație |
de obicei au |
mișcare paradoxală a pieptului și a peretelui abdominal |
||
|
șuierătoare |
moderat, adesea numai la expirație |
de obicei tare |
absent |
|
|
puls (pe minut) |
bradicardie |
|||
|
puls paradoxal |
absent |
pot exista 10-25 mm Hg. |
deseori disponibile > 25 mmHg |
lipsa mușchilor respiratori în timpul oboselii |
|
PSV după administrarea unui bronhodilatator |
aproximativ 60-80% |
< 60 % от должных величин | ||
|
PaO2 (când respirați aer) |
<45 мм рт.ст. |
60 mm Hg <45 мм рт.ст. |
< 60 мм рт.ст > 45 mm Hg | |
|
SatO2% (când respirați aer) |
Un exemplu de diagnostic.
De bazăDs: Astm bronșic, endogen, necontrolat, exacerbare severă, DNIIIst.
Figura 10. Tratamentul pacienților cu exacerbarea astmului bronșic (GINA, 2006).
Exacerbarea bolii pulmonare obstructive cronice
La evaluarea simptomelor clinice, se acordă atenție participării mușchilor auxiliari în actul respirației, mișcărilor paradoxale ale pieptului, apariția sau agravarea cianozei centrale, apariția edemului periferic, starea hemodinamicii (instabilitate hemodinamică). Evaluarea funcției respiratorii - scăderea PSV mai puțin de 100 litri pe minut sau FEV 1 mai puțin de 1 litru, pO 2<60 мм рт.ст., сатурация О 2 менее при дыхании комнатным воздухом говорит о тяжелом обострении ХОБЛ. ОФВ 1 на уровне 0,75 л или РаО 2 /FiО 2 32 кПа (240 мм рт. ст.) может хорошо переноситься лицами с тяжелой ХОБЛ, которые живут с этими показателями в стабильном состоянии, в то время как подобные параметры для тех, у кого в стабильном состоянии имеются чуть большие значения, например ОФВ 1 ~0,9 л или РаО 2 /FiО 2 ~ 38 кПа (282 мм рт. ст.), могут указывать на тяжелое обострение.
Gazele arteriale din sânge.Într-un spital cu exacerbare severă a BPOC, determinarea nivelului gazelor arteriale din sânge este obligatorie. Dacă, atunci când respirați aerul din încăpere, PaO 2<8 кПа (60 мм рт. ст.) и/или SaO 2 <90% (причем РаСО 2 может и превышать, и не превышать 6,7 кПа), то это указывает на дыхательную недостаточность. Кроме того, если РаО 2 < 6,7 кП (50 мм рт. ст.), РаСО 2 >9,3 kPa (70 mm Hg) și pH<7,3, то это указывает на угрожающее жизни состояние, которое требует оказания интенсивной терапии.
Alte teste de laborator. Analizele de sânge pot prezenta policitemie (hematocrit> 55%) sau anemie. Numărul leucocitelor nu este de obicei foarte informativ. Prezența sputei purulente în timpul unei exacerbări este un motiv suficient pentru începerea tratamentului cu antibiotice. Cei mai comuni agenți patogeni în exacerbarea BPOC sunt Streptococcus pneumoniae, Haemophilisinfluenzae și Moraxella catarrhalis. Studiile biochimice pot arăta dacă cauza exacerbării este tulburările electrolitice (hiponatremie, -kalemie etc.), decompensarea diabetului zaharat sau a malnutriției (deficit de proteine) și pot vorbi și despre acidoză metabolică.
Un exemplu de diagnostic
Principala este BPOC, III, exacerbare severă. Complicare: Cor pulmonale acute, AHF. DNIIst.
Tratament
Acasă: exacerbarea BPOC include o creștere a dozei și / sau frecvenței terapiei bronhodilatatoare. Dacă medicamentele anticolinergice nu au fost utilizate înainte, acestea sunt incluse în terapie până când starea se ameliorează. În cazuri mai severe, terapia cu nebulizator cu doze mari poate fi prescrisă după cum este necesar timp de câteva zile. Cu toate acestea, după ce un episod acut a dispărut, nu se recomandă utilizarea prelungită a nebulizatorului pentru terapia de rutină. Corticosteroizii sistemici au fost folosiți cu succes pentru tratarea exacerbărilor BPOC. Acestea reduc timpul de remisiune și ajută la restabilirea funcției pulmonare mai repede. Utilizarea lor trebuie luată în considerare cu FEV 1<50% от должного. Рекомендуется преднизолон в дозе 40 мг в сутки в течение 10 дней. Антибиотики эффективны тогда, когда у больного с усилившейся одышкой и кашлем нарастает объем и гнойность отходящей мокроты.
Tratamentul internat
Indicații pentru spitalizare
O creștere semnificativă a intensității simptomelor, cum ar fi debutul brusc al dispneei în repaus
Pre-exacerbare severă a BPOC
Noi manifestări clinice (de exemplu, cianoză, edem periferic)
Incapacitatea de a opri exacerbarea cu medicamentele utilizate inițial
Comorbilități grave
Aritmii nou manifestate
Incertitudine diagnostic
Vârstă
Ajutor insuficient acasă
Indicații pentru trimiterea la secția de terapie intensivă
Respirație severă cu răspuns inadecvat la terapia inițială de urgență
Conștiință confuză, letargie, comă
Hipoxemie persistentă sau înrăutățită (PaO 2<5,3 кПа, или 40 мм рт. ст.), и/или тяжелая/ухудшающаяся гиперкапния (PaCO 2 >8 kPa sau 60 mm Hg. Art.), Și / sau acidoză respiratorie severă / înrăutățită (pH<7,25), несмотря на оксигенотерапию и неинвазивную вентиляцию легких
Tratarea exacerbărilor severe, dar care nu pun viața în pericol
1. Prescrieți oxigenoterapia ghidată (2-5 L / min, cel puțin 18 ore / zi) și repetați măsurătorile gazelor arteriale din sânge după 30 de minute
2. Bronhodilatatoare: creșteți doza sau frecvența administrării, combinați beta2-agoniști și anticolinergici, utilizați distanțiere sau nebulizatoare compresoare (bromură de ipratropiu 0,25-0,5 mg (20-40 picături) printr-un nebulizator cu O 2 în combinație cu p-rami de beta-agoniști cu acțiune scurtă: salbutamol 2,5-5 mg. sau fenoterol 0,5-1,0 mg (10-20 picături) după 6 ore.) printr-un nebulizator cu O 2, apoi 1,5-2 ml după 6 ore în timpul zilei)
Luați în considerare ∕ în aminofilină (aminofilină 240 mg / h până la 960 mg / zi la o rată de 0,5 mg / kg / h sub îndrumare ECG)
3. Adăugați GCS oral sau intravenos (40 mg / zi timp de 10 zile, dacă este imposibil să intravenos parenteral până la 3 mg / kg / zi)
4. Dacă există semne ale unei infecții bacteriene, luați în considerare antibioticele orale sau intravenoase.
5. Pe tot parcursul terapiei: monitorizați echilibrul fluidelor și al nutrienților, luați în considerare heparina subcutanată, identificați și tratați afecțiunile asociate (de exemplu, insuficiență cardiacă, aritmii), monitorizați cu atenție starea pacientului