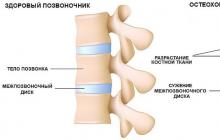
La syphilis est une maladie infectieuse causée par le spirochète Treponema pallidum, sujette à cours chronique, avec une périodisation claire des symptômes cliniques.
La prédominance de la voie de transmission sexuelle sur la voie de contact et transplacentaire place cette maladie dans un certain nombre de maladies sexuellement transmissibles (MST, IST). En plus de ces méthodes de transmission de l'infection, une voie artefactuelle (du latin "artificio" - créé artificiellement) joue un rôle particulier.
Il est typique des institutions médicales, principalement mis en œuvre en milieu hospitalier. L'infection survient lors de transfusions sanguines, de diverses opérations chirurgicales, de méthodes de diagnostic invasives.
Malgré la quarantaine des dons de sang, le problème de la détection de la syphilis chez les donneurs à différents stades de la maladie reste d'actualité.
C'est pourquoi mesures diagnostiques avec la syphilis, ils nécessitent une normalisation, l'introduction de nouvelles méthodes d'identification sensibles et informatives, ainsi que la minimisation des erreurs et des interprétations erronées des résultats des tests.
- 1 Dépistage et examen clinique de groupes de population (incluant grossesse, inscription aux consultations prénatales, emploi et inscription d'un dossier médical, etc.).
- 2 Dépistage dans les groupes à risque (rapports sexuels non protégés avec une personne infectée par la syphilis, personnes après rapports sexuels forcés, infectées par le VIH, etc.).
- 3 Individus présentant des symptômes ou une infection syphilitique suspectée.
- 1 Identification de Treponema pallidum en fond noir (microscopie à fond noir).
- 2 Infection d'animaux de laboratoire (élevage sur animaux de laboratoire).
- 3 PCR (réaction en chaîne par polymérase).
- 4 sonde ADN ou hybridation acides nucléiques.
- 1 Tests non tréponémiques :
- réaction de Wasserman (RSK);
- Réaction de microprécipitation (MR, RMP) et ses analogues, qui sont donnés ci-dessous ;
- Test Rapide de Réagine Plasma (RPR, RPR);
- Test de sérum au rouge de toluidine (TRUST) ;
- Test non tréponémique du Laboratoire de Recherche sur les Maladies Sexuellement Transmissibles - VDRL.
- 2 tests tréponémiques :
- P-tion d'immobilisation de Treponema pallidum - RIBT/RIT ;
- P-tion d'immunofluorescence - RIF, FTA (dilution du sérum RIF-10, RIF-200, RIF-abs);
- P-tion d'hémagglutination passive (RPHA, TRPGA, TPHA) ;
- Test immuno-enzymatique (ELISA, EIA) ;
- Immunobuvardage.
- 1 La sensibilité minimale au stade de la syphilis primaire est de 70 % ;
- 2 Sensibilité minimale au stade de la syphilis tardive - 30%;
- 3 Possibilité de résultats faux négatifs et faux positifs ;
- 4 La complexité de la mise en œuvre de la RSK.
- 1 Coût de production des tests relativement faible ;
- 2 Obtenir une réponse rapide ;
- 3 Possibilité de leur utilisation pour le dépistage.
- 1 Violation de la technologie d'exécution, lors du blocage du complexe AG-AT.
- 2 La présence de maladies auto-immunes chez le patient (polyarthrite rhumatoïde, rhumatismes, sclérodermie, lupus érythémateux disséminé, sarcoïdose, etc.).
- 3 Tumeurs malignes.
- 4 Infections virales et bactériennes.
- 5 Maladies endocriniennes ( thyroïdite auto-immune, Diabète).
- 6 Grossesse.
- 7 Boire de l'alcool.
- 8 Réception des aliments gras.
- 9 Âge sénile.
- 1 sensibilité relativement élevée ;
- 2 spécificité relativement élevée ;
- 3 facilité de mise en œuvre ;
- 4 faible coût des réactifs;
- 5 obtenir une réponse rapide.
- 1 De 0 à 20 - échantillon négatif.
- 2 De 21 à 50 - test faiblement positif.
- 3 De 50 à 100 - une réaction positive.
- 1 La réponse maximale (test fortement positif) est indiquée par 4 croix.
- 2 Un échantillon positif est indiqué par 3 croix.
- 3 Une réaction faiblement positive est indiquée par deux croix.
- 4 Une croix indique un résultat douteux et négatif.
- 5 Une réponse négative est signalée par un signe moins.
Afficher tout
1. Classification des méthodes de diagnostic de laboratoire
Le diagnostic de la syphilis présente certaines particularités et diffère du diagnostic d'autres infections bactériennes. La structure complexe et les propriétés antigéniques du tréponème pâle provoquent des erreurs dans l'interprétation des résultats des réactions sérologiques.
Un test sanguin pour la syphilis est proposé à 3 groupes principaux de patients :
Tout méthodes de laboratoire conditionnellement subdivisé en direct et indirect.
1.1. Méthodes directes
1.2. Méthodes indirectes
Les tests sérologiques sont des méthodes diagnostic de laboratoire, basé sur la détection d'anticorps (en abrégé AT) dirigés contre les antigènes du tréponème pâle (en abrégé AH). Ils sont indispensables pour confirmer le diagnostic.

Figure 1 - Algorithme de sérodiagnostic de la syphilis
1.3. Méthodes histomorphologiques
Ces méthodes se réduisent à identifier les caractéristiques de l'histomorphologie des manifestations syphilitiques. L'attention est portée sur les subtilités de la structure du chancre dur. Cependant, le diagnostic différentiel de l'infection à l'aide de l'histologie est très difficile. L'histomorphologie est utilisée avec d'autres tests de laboratoire et cliniques.
2. Microscopie de Treponema pallidum dans un champ sombre
Cette méthode est basée sur la détection directe du tréponème pâle dans le matériel d'essai à l'aide d'un microscope et de dispositifs spéciaux (le plus souvent écoulement d'érosions et d'ulcères, moins souvent de liquide céphalo-rachidien et d'autres substrats).
À l'aide de scarification, de grattage, de compression des érosions et des défauts ulcéreux, un exsudat est obtenu, puis la préparation préparée est examinée au microscope.
Habituellement, les tréponèmes pâles sont détectés dans une préparation obtenue à partir d'un chancre, à partir de foyers de syphilis secondaire fraîche et récurrente, ainsi que de ponctuation des ganglions lymphatiques, le placenta.
Basée sur le phénomène de lueur de petites particules dans un champ sombre lorsqu'un rayon de lumière frappe (phénomène de Tyndall), la méthode permet parfaitement de différencier l'agent causal de la syphilis des autres tréponèmes sur la base de différences morphologiques et de différences dans le modes de déplacement de la bactérie.
Pour la microscopie, un condenseur spécial à fond noir de résolution optique appropriée est utilisé. La préparation est obtenue par la méthode de la goutte écrasée (une goutte de matière est appliquée sur une lame de verre propre dégraissée et recouverte d'une lamelle très fine).
L'huile d'immersion tombe sur le couvercle en verre. En tournant le tube et en tournant la loupe, l'éclairage souhaité est ajusté.
Dans le champ sombre du microscope, on trouve des cellules sanguines, des cellules épithéliales et l'agent causal de la syphilis. Treponema pallidum ressemble à une spirale, très fine, émettant une couleur argentée, avec des mouvements fluides.

Figure 2 - Microscopie à fond noir comme moyen de visualiser le tréponème pâle dans le matériel d'essai. Source de l'illustration - CDC
Treponema pallidum doit être distingué des autres tréponèmes, dont Tr. refringens, que l'on retrouve dans l'oropharynx et sur la muqueuse génitale. Cette bactérie fait des mouvements chaotiques, a des boucles larges et asymétriques, plutôt grossières. De plus, Treponema pallidum se distingue de Tr. Microdentium, Tr. Buccalis et Tr. vincenti.
La visualisation des bactéries dans un champ sombre est parfois complétée par une réponse de fluorescence. Pour cela, des anticorps anti-tréponémiques marqués avec un colorant fluorescent sont ajoutés au matériel natif. Cela forme un complexe appelé antigène-anticorps (en abrégé AG-AT), qui fait l'objet d'une enquête à l'aide d'un microscope à fluorescence.
3. Méthode de réaction en chaîne par polymérase (PCR)
La PCR, développée en 1991 pour détecter la molécule d'acide désoxyribonucléique (ADN) du tréponème pâle, est très sensible et spécifique, elle permet de détecter des fragments d'ADN du pathogène.
Cette analyse est basée sur la copie de courtes sections de l'ADN du spirochète pallidum, qui répond aux paramètres spécifiés et est présent dans l'échantillon. Tout cela se fait in vitro. La réaction est effectuée dans un appareil - un amplificateur, qui assure la périodisation des cycles de température. Un refroidissement se produit, suivi d'un chauffage des tubes avec une erreur de 0,1 .
La matrice d'ADN est chauffée pendant 2 minutes à une température de 92-98°C (la température maximale est utilisée si la polymérase est thermostable). Lorsqu'ils sont chauffés, les brins d'ADN divergent en raison de la rupture des liaisons hydrogène entre eux. Dans l'étape d'annelage, la température de réaction est réduite pour lier l'amorce à la matrice simple brin.
Le recuit prend environ 30 secondes, pendant lesquelles des centaines de nucléotides sont synthétisés. Les molécules nouvellement synthétisées sont copiées par la polymérase, en conséquence, des fragments spécifiques d'acide désoxyribonucléique sont multipliés. La détection ultérieure des fragments est effectuée par électrophorèse sur gel d'agar.
Le diagnostic PCR de la syphilis est encore de nature expérimentale, mais il est justifié lorsqu'une infection congénitale est détectée, dans des cas de diagnostic difficiles, ou avec une teneur minimale en tréponèmes pâles dans le matériel de test.
4.L'hybridation de l'ADN
L'hybridation d'ADN est réalisée in vitro et est basée sur la combinaison complète ou partielle de deux molécules d'ADN simple brin en une seule molécule. Dans le cas d'une correspondance complète des fragments complémentaires, l'union est facile. Si la correspondance complémentaire est partielle, alors l'unification des brins d'ADN est lente. Sur la base du moment de la fusion des brins, le degré de complémentarité peut être évalué.
Lorsque l'ADN est chauffé dans une solution tampon, les liaisons hydrogène sont rompues par les bases azotées, qui sont complémentaires, de sorte que les chaînes d'ADN divergent. Ensuite, une préparation est obtenue à partir de deux acides désoxyribonucléiques dénaturés. Lors du refroidissement, les régions simple brin sont renaturées. Un soi-disant hybride d'ADN est formé.
La méthode permet d'évaluer et d'analyser le taux d'hybridation, en tenant compte des caractéristiques (similitudes et différences) de l'ADN entre espèces ou au sein d'une espèce.
L'utilisation d'une sonde d'ADN consiste en l'hybridation d'un fragment d'ADN marqué avec une région d'ADN spécifique pour identifier des séquences nucléotidiques complémentaires. Un groupe d'atomes insaturés (chromophores) ou d'isotopes radioactifs sont utilisés pour marquer la sonde.
Une sonde ADN est utilisée pour la détection hétérogène et homogène d'acides nucléiques. Le rôle de la sonde est d'identifier les zones où la fusion cible-sonde s'est produite. La détection dans un système homogène a l'avantage de permettre de suivre l'hybridation des molécules d'ADN en temps réel.
L'essence de la méthode est réduite à la dénaturation et à la renaturation de l'ADN (réunification des brins d'ADN). Le processus de renaturation de l'acide nucléique et de la sonde ADN se termine par la formation d'un « hybride ».
Des séquences d'acide nucléique spécifiques s'hybrident avec une sonde d'ADN et, ainsi, sont identifiées et permettent d'estimer la quantité d'ADN dans le matériel d'essai.
5. Infection des animaux de laboratoire
La grande sensibilité des lapins à Treponema pallidum (environ 99,9%) leur permet d'être utilisés dans le diagnostic de l'infection syphilitique.
L'infection des lapins est réalisée dans des centres de recherche et constitue le "gold standard" pour évaluer la sensibilité d'autres méthodes.
Revenons aux tests tréponémiques et non tréponémiques, car ils sont le plus souvent utilisés. Considérons leurs avantages et leurs inconvénients, ainsi que les erreurs d'interprétation des résultats.
6. Tests non tréponémiques
Ce sont des tests de définition Anticorps IgG et IgM à l'antigène de cardiolipine standardisé. Leur inconvénient majeur est leur spécificité relativement faible.
Le faible coût et la facilité de mise en œuvre rendent ces tests qualifiants des tests diagnostiques nécessaires à l'établissement d'un diagnostic préalable et au dépistage dans la population.
Ce sont des tests non tréponémiques qui sont passés lors de l'enregistrement d'un livre médical, de la candidature à un emploi, de l'inscription dans une clinique prénatale.
Désavantages:
Avantages :
L'obtention d'échantillons faux positifs ou faiblement positifs est possible dans les cas suivants :
Comme vous pouvez le voir dans la liste, il y a suffisamment de raisons pour un mauvais résultat. Il faut donc s'en méfier beaucoup. Considérons, avec le RSK, deux autres échantillons. Il s'agit d'une réaction de microprécipitation et de VDLR (sa modification).
7. Réaction du complément de liaison (RSK, Wasserman, RW)
Il s'agit d'un test basé sur la capacité du complément à se lier aux complexes AG-AT. Le complexe formé est identifié à l'aide du système hémolytique. L'antigène cardiolipine augmente considérablement la sensibilité de l'échantillon.
La réaction de Kolmer est également sensible, qui consiste à effectuer à différentes conditions de température. Ainsi, la première phase de la réaction de Kolmer se déroule à une température de 20˚C pendant une demi-heure, la deuxième phase à une température de 4-8˚C pendant 20 heures. Pendant ce temps, la liaison du complément se produit.
Lors de l'exécution de RSK, il est possible d'obtenir des résultats nettement positifs. La raison en est probablement le titre élevé d'anticorps dans le sérum non dilué. Dans ce cas, les prélèvements sont effectués à doses décroissantes.
Pour différencier les stades de la syphilis et évaluer l'efficacité du traitement antisyphilitique, la quantité d'AT dans le sérum est déterminée.
La positivité de l'échantillon est évaluée à l'aide de croisements et la dilution du sérum est également indiquée dans les réactions de Wasserman, Colmer et Kann.
8. Réaction de microprécipitation
Étant donné que la réalisation des tests ci-dessus est très laborieuse, une méthode accélérée de sérodiagnostic de la syphilis a été développée pour couvrir l'étendue de l'examen médical de différents groupes de la population, la méthode dite expresse - une réaction de microprécipitation (en abrégé MR, RMP).
Elle est réalisée avec l'antigène cardiolipine et des excipients. Son avantage est la collecte de sang périphérique pour la recherche. Cela accélère considérablement à la fois la technique elle-même et le travail des techniciens de laboratoire.

Figure 2 - La réaction de microprécipitation (schéma)
Pour l'IRM, le plasma ou le sérum sanguin inactivé du patient est requis (ils contiennent des anticorps). Ensuite, le plasma est placé dans les puits marqués. Ensuite, une goutte d'antigène cardiolipine est ajoutée au matériel de test, mélangé et secoué. En conséquence, des flocons caractéristiques apparaissent dans le sérum d'une personne infectée, d'intensité variable.
Il s'agit d'un test de qualité. La quantification utilise 10 dilutions de sérum placées dans 10 puits étiquetés de manière appropriée. Avec l'IRM qualitative, la réponse est indiquée sous forme de croix (plus) ou moins, avec quantitatif, le titre d'anticorps est indiqué (1 : 2, 1 : 4, etc.).
La présence de paillettes est considérée comme une réponse positive ou faiblement positive. L'apparition d'un floculat est possible même en l'absence de maladie, par conséquent, l'évaluation finale du résultat obtenu est réalisée après une étude de contrôle ou d'autres réactions (RIBT, RIF, ELISA, RPGA).
9.VDRL
La méthode de mise en scène d'une réaction avec un antigène lipoïde (AG), recommandée par l'Organisation mondiale de la santé, est à juste titre considérée comme la meilleure parmi les autres tests non tréponémiques standard. Développé aux États-Unis, en Géorgie dans les laboratoires de recherche sur les maladies vénériennes.
L'abréviation de l'institution a servi de nom à l'échantillon - VDRL. VDRL est une modification du MP. Le sérum d'un patient atteint de syphilis est inactivé et placé sur une lame de verre. L'antigène utilisé est constitué de cardiolipine, de cholestérol et de lécithine en pourcentages variables. La réponse est enregistrée presque immédiatement.
Une floculation distincte se produit en présence d'anticorps dans le sérum. Le sérum devient réactif 4 semaines après l'infection. Pour évaluer la quantité d'anticorps, le sérum est préalablement dilué de façon exponentielle.
Avantages VDRL :
L'inconvénient du VDRL est sa relative haute fréquence résultats faux positifs.
Leurs causes sont toutes les mêmes maladies énumérées ci-dessus.
Les tests tréponémiques sont effectués avec des antigènes spécifiques de Treponema pallidum. Ils sont nécessaires et obligatoires pour établir diagnostic final... Il s'agit d'une réaction d'immunofluorescence (RIF), d'une réaction d'hémagglutination indirecte (RPHA), d'un dosage immuno-enzymatique (ELISA), etc.
Après un résultat positif d'un test non tréponémique (RPR, MP, VDRL), des tests tréponémiques doivent toujours être effectués (le plus souvent une combinaison - RPGA, ELISA, RIF).
Les tests tréponémiques sont plus difficiles à réaliser que les tests rapides et sont coûteux De l'argent.
10. FRR
Cette réaction (en abrégé RIF) est utilisée pour diagnostiquer la syphilis, y compris les formes latentes, et revérifier les échantillons positifs et faux positifs.
Le RIF est basé sur la lueur des anticorps marqués lorsqu'ils sont combinés avec un complexe antigène-anticorps sous une lampe à quartz. La méthode a commencé à être appliquée dans les années 60 et se distinguait par sa facilité de mise en œuvre et sa spécificité élevée (légèrement inférieure à RIBT).
Il a plusieurs modifications : RIF-10, RIF-200 et RIF-abs.
Le RIF est plus sensible lorsqu'il est dilué 10 fois, et le reste est plus spécifique. Le RIF se déroule en deux phases. Le sérum sanguin du patient est ajouté à l'hypertension. Un complexe AG-AT est formé, qui est étudié dans la phase suivante. De plus, le complexe marqué au fluoochrome est identifié par microscopie. Si aucune luminescence n'est observée, cela indique l'absence d'anticorps spécifiques dans le sérum sanguin.
RIF-200 est la plus précieuse de toutes les dilutions. La méthode est destinée au diagnostic différentes formes la syphilis, en particulier la syphilis latente et le recoupement des échantillons positifs.
11. RIBT
La réaction d'immobilisation du tréponème pâle (en abrégé RIBT, RIT) est l'un des tests sérologiques les plus difficiles qui nécessitent des efforts et des coûts financiers importants. Le RIBT est de moins en moins utilisé, mais sa pertinence demeure dans le diagnostic de la syphilis latente.
Il est d'une grande importance pour reconnaître les résultats faussement positifs chez les femmes enceintes et repose sur l'immobilisation de bactéries en présence d'immobilisines - anticorps tardifs.
Le résultat est évalué sur le pourcentage (%) de tréponèmes immobilisés à l'aide d'un tableau spécial :
Des résultats faussement positifs sont également possibles avec RIBT. Ainsi, une réponse incorrecte est possible en cas d'infection par la trépanématose tropicale, ainsi que par la tuberculose, la cirrhose du foie, la sarcoïdose et les patients âgés.
12. RPGA
Ce test sanguin pour la syphilis est appelé réaction d'hémagglutination passive (en abrégé sang pour RPHA, TRPHA).
L'antigène pour la RPHA est préparé à partir d'érythrocytes de mouton recouverts de fragments de tréponème pâle (obtenus à partir de lapins infectés (voir figure 4)). Le sang veineux du patient (plasma ou sérum inactivé) est utilisé pour l'analyse.
Lorsque l'antigène est ajouté au sérum d'un patient atteint de syphilis, un complexe AG-AT se forme, ce qui conduit à l'agglutination des érythrocytes. l'agglutination est déterminée subjectivement par un assistant de laboratoire.

Figure 3 - Schéma de la RPHA (réaction d'hémagglutination passive)
L'échantillon est évalué comme positif lorsque des agglutinats de couleur rose uniforme apparaissent. La coloration rouge du précipité indique le dépôt d'érythrocytes. Le RPHA est hautement sensible et hautement spécifique.
12.1. Réaction de microhémagglutination
C'est une version simplifiée du RPGA. Il diffère de l'échantillon décrit ci-dessus en ce qu'il y a moins d'antigène, de diluant et de sérum sanguin pour effectuer la réaction. 4 heures après l'incubation du sérum, l'échantillon peut être évalué. Il est utilisé pour le dépistage et les tests de masse de la syphilis.
13. Test immuno-enzymatique
Le dosage immuno-enzymatique (ELISA en abrégé) est basé sur une réaction spécifique antigène-anticorps. Du matériel biologique (sérum sanguin du patient, liquide céphalo-rachidien) est introduit dans les puits, sur la surface solide desquels sont fixés les antigènes de tréponème pallidum. Le matériel de test est incubé, puis les anticorps qui ne se lient pas aux antigènes sont éliminés par lavage (voir Figure 5).
Le complexe résultant est identifié au stade de la fermentation à l'aide de sérum immun marqué par une enzyme. Dans une réaction chimique, l'enzyme colore les complexes résultants. L'intensité de la coloration dépend de la quantité d'anticorps spécifiques dans le sang du patient et est enregistrée avec un spectrophotomètre.

Figure 4 - Schéma ELISA (essai immuno-enzymatique)
La sensibilité ELISA est supérieure à 95%. La méthode est utilisée en mode automatisé pour étudier des groupes de population décrétés : donneurs, femmes enceintes et autres, pour clarifier le diagnostic avec des tests non tréponémiques positifs et faux positifs.
14. Immunobuvardage
L'immunobuvardage est une méthode très sensible, une modification d'un simple ELISA. La réaction est basée sur l'électrophorèse avec séparation des antigènes des tréponèmes pâles.
Les immunodéterminants séparés sont transférés sur papier nitrocellulosique et développés en ELISA. Ensuite, le sérum est incubé et les anticorps non liés sont lavés. Le matériel résultant est traité avec des immunoglobulines marquées par une enzyme (IgM ou IgG).
15. Évaluation clinique des résultats du diagnostic de laboratoire de la syphilis
Dans le tableau 1 ci-dessous, nous avons montré les résultats possibles des tests et leur interprétation. Comme vous pouvez le voir dans le tableau, une évaluation complète des tests est d'une importance primordiale dans le décodage.

Tableau 1 - Interprétation des résultats des réactions sérologiques (tests sanguins pour la syphilis). Pour visualiser, cliquez sur le tableau
L'évaluation de la réactivité des tests est également réalisée avec des « croix » :
Le problème de l'optimisation des diagnostics de laboratoire de la syphilis n'a pas perdu de sa pertinence à ce jour. Méthodes modernes Les diagnostics, malgré la volonté des scientifiques d'apporter des diagnostics à la sensibilité et à la spécificité les plus élevées possibles, nécessitent un contrôle de contrôle et une approche individuelle.
Une caractéristique de l'infection syphilitique est le phénomène de sérorésistance, qui n'a jamais reçu d'explication scientifique. Le diagnostic est posé après un examen complet du patient par des méthodes épidémiologiques, cliniques et de laboratoire.
Dans le contexte du développement économique et technique de la médecine, des progrès sont également observés dans le développement de nouveaux critères pour le diagnostic de la syphilis. Tout cela vous permettra de traiter les patients rapidement, avec succès et avec précision.
Ponction des ganglions lymphatiques régionaux
La peau au-dessus des ganglions lymphatiques est traitée avec 96% d'alcool et 3-5% solution d'alcool iode. Ensuite, 1 et 2 doigts de la main gauche fixent le ganglion lymphatique. Main droite prendre une seringue stérile avec quelques gouttes de solution isotonique de chlorure de sodium, qui est injectée parallèlement à l'axe longitudinal du ganglion lymphatique. L'aiguille est poussée dans différentes directions jusqu'à la paroi opposée de la capsule d'assemblage et le contenu de la seringue est injecté lentement. Le ganglion lymphatique est légèrement massé avec les doigts de la main gauche. Avec un retrait lent de l'aiguille, le piston de la seringue est simultanément étendu, aspirant le contenu du ganglion lymphatique. Le matériau est appliqué sur une lame de verre (avec une petite quantité de matériau, une goutte de solution isotonique de chlorure de sodium est ajoutée), recouverte d'un couvercle en verre. L'étude de la préparation native est réalisée en champ sombre à l'aide d'un microscope optique à fond noir (objectif 40, 7x, 10x ou 15x). Des tréponèmes pâles peuvent également être trouvés dans les préparations colorées. Lorsqu'ils sont colorés selon Romanovsky-Giemsa, les tréponèmes pâles sont colorés en rose, selon Fontan et Morozov en brun (noir), selon la méthode de Burri, les tréponèmes non colorés sont révélés sur un fond sombre.Diagnostic sérologique
D'une grande importance dans le diagnostic de la syphilis, l'évaluation de l'efficacité du traitement, l'établissement d'un critère de guérison, la détection des formes latentes et résistantes sont attachés aux réactions sérologiques standard (classiques) et spécifiques. Les tests sérologiques standards ou classiques (CSR) comprennent :- réaction de Wasserman (RV),
- réactions sédimentaires de Kahn et Sachs-Vitebsk (cytocholiques),
- réaction sur verre (méthode express),
- la réaction d'immobilisation des tréponèmes pâles (RIBT),
- réaction d'immunofluorescence (RIF).
Réaction de Wasserman (RV)
- développé par A. Wasserman avec A. Neisser et C. Bruck en 1906. La réaction de Wasserman est basée sur le phénomène de liaison au complément (réaction de Bordet-Zhangu) et permet la détection d'anticorps anti-lipides (réagines). Selon les concepts modernes, les anticorps dirigés contre les lipides du macro-organisme sont déterminés dans la réaction de Wasserman, et non le tréponème pâle, et la réaction révèle un processus auto-immun causé par la dénaturation des tréponèmes pâles des tissus du macro-organisme avec formation de un complexe lipoprotéique (conjugué), dans lequel les lipides (haptènes) sont le déterminant.Habituellement, le RV est administré avec deux ou trois antigènes. Les plus couramment utilisés sont l'antigène cardiolipine hautement sensible (extrait de cœur de bovin enrichi en cholestérol et lécithine) et l'antigène tréponémique (suspension traitée par ultrasons de tréponèmes pâles culturels anatogènes). Avec les réactifs du sérum sanguin du patient, ces antigènes forment un complexe immun capable d'adsorber et de lier le complément. Pour déterminer visuellement le complexe formé (réagine + antigène + complément), un système hémolytique (un mélange d'érythrocytes de mouton avec du sérum hémolytique) est utilisé comme indicateur. Si le complément est associé à la phase 1 de la réaction (réagines + antigène + complément), l'hémolyse ne se produit pas - les érythrocytes précipitent dans un sédiment facilement perceptible (PB positif). Si en phase 1 le complément n'est pas lié en raison de l'absence de réagines dans le sérum testé, il sera utilisé par le système hémolytique et une hémolyse se produira (PB négatif). La sévérité de l'hémolyse dans le cadre du RV s'apprécie par ses avantages : absence totale d'hémolyse ++++ ou 4+ (RV nettement positif) ; hémolyse à peine commencée +++ ou 3+ (PB positif); hémolyse significative ++ ou 2+ (le PB est faiblement positif) ; image incompréhensible de l'hémolyse ± (PB est douteux); hémolyse complète - (la réaction de Wasserman est négative).
En plus de l'évaluation qualitative du RV, il existe une formulation quantitative avec différentes dilutions de sérum (1:10, 1:20, 1:80, 1:160, 1:320). Le titre de réagines est déterminé par la dilution maximale, qui donne toujours un résultat nettement positif (4+). Le cadre quantitatif de la RV est important dans le diagnostic de certaines formes cliniques d'infection syphilitique, ainsi que dans le suivi de l'efficacité du traitement. Actuellement, la réaction de Wasserman est posée avec deux antigènes (cardiolipine et souche de Reiter tréponémique). En règle générale, le RV devient positif 5 à 6 semaines après l'infection chez 25 à 60 % des patients, à 7 à 8 semaines - à 75 à 96 %, à 9 à 19 semaines - à 100 %, bien que dans dernières années parfois tôt ou tard. Dans le même temps, le titre de réagines augmente progressivement et atteint une valeur maximale (1 : 160-1 : 320 et plus) en cas d'apparition d'éruptions cutanées généralisées (syphilis fraîche secondaire). Lorsque le RV est positif, un diagnostic de syphilis primaire séropositive est posé.
Avec frais secondaire et la syphilis récurrente secondaire, le RV est positif chez 100 % des patients, mais chez les patients émaciés avec une immunité affaiblie, un résultat négatif peut être observé. Par la suite, le titre de reagines diminue progressivement et avec la syphilis récurrente secondaire ne dépasse généralement pas 1: 80-1: 120.
Avec la syphilis tertiaire Le RV est positif chez 65 à 70 % des patients et le titre de réagines est généralement faible (1 : 20-1 : 40). Dans les formes tardives de syphilis (syphilis des organes internes, système nerveux) un RV positif est observé dans 50 à 80 % des cas. Le titre de reagines varie de 1: 5 à 1: 320.
Avec la syphilis latente Un RV positif est observé chez 100% des patients. Le titre de réagines est de 1:80 à 1: 640, et dans la syphilis latente tardive de 1:10 à 1:20. Une diminution rapide du titre de réagines (jusqu'à une négativité complète) pendant le traitement indique l'efficacité du traitement.
Inconvénients de la réaction de Wasserman- sensibilité insuffisante (en stade initial la syphilis primaire est négative). Elle est également négative chez 1/3 des patients, s'ils ont été traités par antibiotiques dans le passé, chez les patients atteints de syphilis active tertiaire avec lésions de la peau et des muqueuses, de l'appareil ostéoarticulaire, des organes internes, du système nerveux central, avec syphilis congénitale.
Manque de spécificité- La réaction de Wasserman peut être positive chez les personnes qui n'ont jamais été malades ou qui n'ont pas la syphilis. En particulier, des résultats faussement positifs (non spécifiques) de RV sont observés chez les patients souffrant de lupus érythémateux disséminé, de lèpre, de paludisme, de tumeurs malignes, de lésions hépatiques, d'infarctus du myocarde étendu et d'autres maladies, et parfois chez des personnes en parfaite santé.
Une réaction de Wasserman faussement positive à court terme est détectée chez certaines femmes avant ou après l'accouchement, chez les toxicomanes, après anesthésie, consommation d'alcool. En règle générale, le faux positif RV est faiblement exprimé, le plus souvent avec un faible titre de réactifs (1 : 5-1 : 20), positif (3+) ou faiblement positif (2+). Dans les examens sérologiques de masse, la fréquence des résultats faussement positifs est de 0,1 à 0,15%. Pour pallier le manque de sensibilité, ils utilisent la mise en scène au froid (Collar reaction) et en même temps elle est mise en scène avec d'autres réactions sérologiques.
Réactions sédimentaires de Kahn et Sachs-Vitebsky
La réaction de Wasserman est utilisée en combinaison avec deux réactions sédimentaires (Kahn et Sachsa-Vitebsky), lorsqu'elles sont mises en scène, des antigènes plus concentrés sont préparés. Méthode express (micro-réaction sur verre) - fait référence aux réactions lipidiques et est basée sur une réaction de précipitation. Il est placé avec un antigène cardiolipine spécifique, dont 1 goutte est mélangée à 2 à 3 gouttes du sérum sanguin à tester dans les puits d'une plaque de verre spéciale.Avantage- la rapidité de réception d'une réponse (après 30-40 minutes). Les résultats sont jugés par la quantité de précipitations et la taille des flocons. La gravité est définie comme DAC - 4+, 3+, 2+ et négative. Il convient de noter que des résultats faussement positifs sont observés plus souvent qu'avec RV. En règle générale, la méthode express est utilisée pour les examens de masse de la syphilis, lors des examens dans les laboratoires de diagnostic clinique, les services somatiques et les hôpitaux. Sur la base des résultats de la méthode express, le diagnostic de la syphilis est interdit, son utilisation chez les femmes enceintes, les donneurs, ainsi que pour le contrôle après le traitement est exclue.
Réaction d'immobilisation de Treponema pallidum (RIBT)
Réaction d'immobilisation de Treponema pallidum (RIBT)- proposé en 1949 par R.W. Nelson et M.Mayer. C'est le test de diagnostic le plus spécifique de la syphilis. Cependant, la complexité et le coût élevé du réglage limitent son application. Dans le sérum sanguin des patients, des anticorps spécifiques à la vidéo (immobilizines) sont déterminés, ce qui conduit à l'immobilité des tréponèmes pâles en présence de complément. L'antigène est un tréponème pâle pathogène vivant sécrété par des lapins infectés par la syphilis. A l'aide d'un microscope, les tréponèmes pâles ayant perdu leur mobilité (immobilisés) sont comptés et les résultats du RIBT sont évalués : immobilisation des tréponèmes pâles de 51 à 100 % - positifs ; de 31 à 50% - faiblement positif; de 21 à 30% - douteux; de 0 à 20% - négatif.RIBT compte quand diagnostic différentiel distinguer les réactions sérologiques faussement positives des réactions causées par la syphilis. Late devient positif que RV, RIF et donc il n'est pas utilisé pour diagnostiquer les formes infectieuses de la syphilis, bien que dans la période secondaire de la syphilis, il est positif chez 85-100% des patients.
Au cours de la période tertiaire de la syphilis avec lésions des organes internes, du système musculo-squelettique, du système nerveux, le RIBT est positif dans 98 à 100 % des cas ( RV est souvent négatif).
Rappelons que le RIBT peut s'avérer faux positif si des médicaments tréponémicides (pénicilline, tétracycline, macrolithes, etc.) sont présents dans le sérum étudié, ce qui provoque une immobilisation non spécifique des tréponèmes pâles. À cette fin, le sang pour RIBT est examiné au plus tôt 2 semaines après la fin de la prise d'antibiotiques et d'autres médicaments.
Le RIBT ainsi que le RIF au cours du traitement sont lentement affectés négativement, il n'est donc pas utilisé comme contrôle au cours du traitement.
Réaction d'immunofluorescence (RIF)
Réaction d'immunofluorescence (RIF)- développé en 1954 par A. Coons et a été utilisé pour la première fois pour le diagnostic de l'infection syphilitique par Deacon, Falcone, Harris en 1957. Le RIF est basé sur une méthode indirecte de détermination des anticorps fluorescents. L'antigène pour la fixation sont des tréponèmes pâles pathogènes des tissus fixés sur des lames de verre, sur lesquelles le sérum d'essai est appliqué. Si le sérum étudié contient des anticorps anti-tréponémiques liés aux IgM et IgG, ils se lient fermement à l'antigène - tréponèmes, qui est détecté au microscope luminescent à l'aide d'un sérum fluorescent anti-espèce ("anti-humain").Résultats RIF sont pris en compte par l'intensité de la luminescence des tréponèmes pâles dans la préparation (lueur jaune-vert). En l'absence d'anticorps anti-tréponémiques dans le sérum, les tréponèmes pâles ne sont pas détectés. En présence d'anticorps, la lueur des tréponèmes pâles est détectée, dont le degré est exprimé en plus: 0 et 1+ - réaction négative; de 2+ à 4+ - positif.
RIF fait référence aux réactions tréponémiques de groupe et est mis dans une dilution du sérum à tester 10 et 200 fois (RIF-10 et RIF-200). RIF-10 est considéré comme plus sensible, cependant, les résultats positifs non spécifiques tombent souvent qu'avec RIF-200 (il a une spécificité plus élevée). D'habitude, RIF devient positif avant RV- positif dans la syphilis primaire séronégative chez 80% des patients, chez 100% dans la période secondaire de la syphilis, toujours positif dans la syphilis latente et dans 95-100% des cas dans les formes tardives et la syphilis congénitale.
Spécificité RIF augmente après un traitement préliminaire du sérum étudié avec un antigène tréponémique sorbant-ultrasonore, qui se lie aux anticorps de groupe (RIF - abs).
Indications pour le réglage RIBT et RIF- diagnostic de syphilis latente pour confirmer la spécificité d'un complexe de réactions lipidiques en cas d'hypothèse d'infection syphilitique sur la base d'un RV positif. RIBT et RIF positifs sont la preuve d'une syphilis latente. En cas de RV faussement positif dans diverses maladies (lupus érythémateux disséminé, tumeurs malignes, etc.) et si les résultats répétés du RIBT et du RIF sont négatifs, cela indique le caractère non spécifique du RV. Suspicion de lésions syphilitiques tardives des organes internes, du système musculo-squelettique, du système nerveux en présence de RV négatif chez les patients. Suspicion de syphilis séronégative primaire, lorsque chez les patients avec des études répétées d'érosion (ulcère) décharge de la surface, avec ponctuation de ganglions lymphatiques régionaux hypertrophiés, le tréponème pâle n'est pas détecté - dans ce cas, seul RIF-10 est placé.
Lors de l'examen de personnes avec un RV négatif qui ont eu des contacts sexuels et familiaux à long terme avec des patients atteints de syphilis, étant donné la possibilité probable de les traiter dans un passé récent avec des médicaments antisyphilitiques qui ont causé un VR négatif. Dosage immuno-enzymatique (ELISA, ELISA - dosage immunoenzymatique) - une méthode développée par E. Engvall et al., S. Avrames (1971). L'essence consiste en la combinaison de l'antigène syphilitique sorbé à la surface du support en phase solide avec l'anticorps du sérum sanguin analysé et la détection d'un complexe antigène-anticorps spécifique à l'aide d'un sérum sanguin immun anti-espèce marqué par une enzyme. Ceci permet d'évaluer visuellement les résultats de l'ELISA par le degré de changement de couleur du substrat sous l'action de l'enzyme incluse dans le conjugué. Des résultats ELISA inexacts peuvent survenir en raison d'une dilution insuffisante des ingrédients, d'une violation des régimes de température et de temps, d'une inadéquation des solutions de pH, d'une contamination de la verrerie de laboratoire et d'une mauvaise technique de lavage du support.
Réaction d'hémagglutination passive (RPHA)
Proposé comme test de diagnostic de la syphilis par T. Rathlev (1965, 1967), T. Tomizawa (1966). La macromodification de la réaction est appelée TPNA, la micromodification est MNA-TP, la version automatisée est AMNA-TR, la réaction avec des macrocapsules de polyurée à la place des érythrocytes est MCA-TP. La sensibilité et la spécificité du RPHA sont similaires à celles du RIBT, du RIF, mais le RPHA a une sensibilité plus faible dans les formes précoces de la syphilis par rapport au RIF-abs et plus élevée dans les formes tardives, avec la syphilis congénitale. Le RPGA est mis en versions qualitative et quantitative.Technique de prélèvement sanguin pour les tests sérologiques
Pour les recherches sur RV, RIF, RIBT, le sang est prélevé dans la veine cubitale à jeun ou au plus tôt 4 heures après un repas avec une seringue stérile ou une aiguille (par gravité). Sur le site de collecte, la peau est prétraitée avec de l'alcool à 70 %. La seringue et l'aiguille doivent être rincées avec une solution isotonique de chlorure de sodium. 5 à 7 ml du sang à tester sont versés dans un tube à essai propre, sec et froid. Un papier vierge avec le nom du patient, les initiales, le numéro d'antécédents médicaux ou le numéro de carte de consultation externe et la date du prélèvement sanguin est collé sur le tube à essai. Après la prise de sang, l'éprouvette est placée au réfrigérateur avec un régime de température de + 4° + 8° C jusqu'au lendemain. Le lendemain, le sérum est drainé pour la recherche. Si le sang n'est pas utilisé le lendemain, le sérum doit être drainé du caillot et conservé au réfrigérateur pendant une semaine maximum. Pour la recherche sur RIBT, le tube doit être spécialement préparé et stérile. En cas de violation des règles de prise de sang pour la recherche, le non-respect des conditions peut entraîner une distorsion des résultats.Il n'est pas recommandé de prélever des échantillons de sang pour la recherche après avoir mangé, alcool, divers médicaments, après l'introduction de divers vaccins, pendant cycle menstruel chez les femmes.
Pour les recherches sur la méthode express, le sang a été prélevé du bout du doigt, comme cela se fait lorsqu'il est prélevé pour la VS, mais le sang est prélevé par 1 capillaire de plus. La méthode express peut également être réalisée avec du sérum sanguin obtenu par ponction veineuse. S'il devient nécessaire de tester le sang dans des laboratoires éloignés, du sérum sec peut être envoyé à la place du sang (méthode de la goutte sèche). Pour ce faire, le lendemain de la prise de sang, le sérum est séparé du caillot et aspiré dans une seringue stérile à raison de 1 ml. Puis le sérum est coulé sous forme de 2 cercles distincts sur une bande de papier à lettres épais (papier ciré ou cellophane) mesurant 6x8 cm.Le nom, les initiales du sujet et la date du prélèvement sanguin sont inscrits sur le bord libre du papier. Protégez le papier avec du sérum des rayons directs du soleil et laissez-le à température ambiante jusqu'au lendemain. Le sérum se dessèche sous forme de petits cercles d'un film vitreux jaunâtre brillant. Après cela, des bandes de papier avec du sérum séché sont enroulées comme une poudre de pharmacie et envoyées au laboratoire, indiquant le diagnostic et dans quel but il est examiné.
Résistance sérologique
Chez certains (2% ou plus) patients atteints de syphilis, malgré le traitement antisyphilitique à part entière, il y a un ralentissement (absence) de réactions sérologiques négatives après la fin du traitement jusqu'à 12 mois ou plus. Il existe une résistance dite sérologique qui, ces dernières années, est devenue fréquemment observée. Il existe des formes de résistance sérologique :- Vrai(absolu, inconditionnel) - il est nécessaire d'effectuer un traitement antisyphilitique supplémentaire, associé à une thérapie non spécifique pour augmenter les forces immunitaires du corps.
- Relatif- après un traitement complet, les tréponèmes pâles forment des kystes ou des formes L, qui se trouvent dans le corps dans un état peu virulent et, par conséquent, un traitement supplémentaire ne modifie pas les indicateurs de réactions sérologiques, en particulier RIF et RIBT.
Pseudo-résistance- après le traitement, malgré des réactions sérologiques positives, le tréponème pâle dans le corps est absent. Il n'y a pas d'antigène dans le corps, mais la production d'anticorps se poursuit, qui sont enregistrées lorsque les réactions sérologiques sont définies.
Une résistance sérologique peut se développer en raison de :
- traitement inadéquat sans tenir compte de la prescription et du stade de la maladie;
- dose insuffisante et, en particulier, en raison de la non prise en compte du poids corporel des patients ;
- violation de l'intervalle entre l'administration de médicaments;
- la préservation des tréponèmes pâles dans le corps malgré le traitement spécifique à part entière, en raison de leur résistance à la pénicilline et aux autres médicaments de chimiothérapie en cas de présence de lésions cachées et encapsulées dans les organes internes, le système nerveux, ganglions lymphatiques qui sont inaccessibles pour médicaments antibactériens(souvent, des tréponèmes pâles se trouvent dans les tissus cicatriciels plusieurs années après la fin du traitement, des tréponèmes pâles se trouvent parfois dans les ganglions lymphatiques 3 à 5 ans après le traitement antisyphilitique);
- déclin forces de protection avec diverses maladies et intoxications (endocrinopathie, alcoolisme, toxicomanie, etc.);
- épuisement général (manger des aliments pauvres en vitamines, protéines, graisses).
- maladies concomitantes non spécifiques des organes internes, troubles du système cardiovasculaire, rhumatismes, dysfonctionnements des systèmes endocrinien et nerveux, dermatoses chroniques sévères, néoplasmes malins;
- lésions du système nerveux (traumatisme grave, commotion cérébrale, traumatisme mental);
- grossesse; intoxication chronique à l'alcool, aux médicaments à la nicotine; maladies infectieuses(paludisme, tuberculose, hépatite virale, dysenterie, typhus, typhoïde et fièvre récurrente).
taille de police
ARRÊTÉ du Ministère de la Santé de l'URSS du 02-09-85 1161 SUR L'AMÉLIORATION DU DIAGNOSTIC SÉROLOGIQUE DE LA SYPHILIS (avec INSTRUCTIONS SUR ... Réel en 2018
Méthode de réglage RIF - ABS
Tester le sérum
Le sang pour obtenir le sérum sanguin est prélevé de la veine cubitale dans un tube à essai propre et sec d'un volume de 5 ml et traité de la même manière que pour le réglage de la réaction de Wasserman. Le sérum sanguin est inactivé une fois à une température de 56 ° pendant 30 minutes. En raison du fait que RIF-abs est placé non stérile, l'utilisation de verrerie stérile et le respect des conditions de stérilité lors du stockage du sérum sanguin ne sont pas nécessaires. Il n'est important que pour une conservation plus longue du sérum sanguin avant l'étude.
Comme antigène, une suspension de tréponèmes pâles pathogènes de la souche Nichols provenant d'une orchite de lapin de 7 jours est utilisée. Des lapins mâles sains avec des résultats négatifs de la réaction de Wasserman et de la RIT sont infectés par voie intratesticulaire et, en cas d'orchite, les tréponèmes pâles sont retirés des testicules de la même manière que dans le cas de la réception de l'antigène pour la RHS. La suspension résultante de tréponèmes pâles est versée des morceaux de testicules dans des tubes à essai stériles avec des bouchons de coton et laissée au réfrigérateur à 4 ° pendant une journée, après quoi elle est séparée du sédiment et dans les mêmes conditions toute la période d'utilisation est conservé.
L'obtention et le stockage de l'antigène nécessitent le respect des conditions de stérilité, car avec le même antigène, la réaction peut être définie en 2 à 4 mois. Pour l'antigène, il faut choisir la suspension dans laquelle on n'observe pas d'agglutination des tréponèmes et en nombre suffisant. L'antigène peut être obtenu en ampoules auprès d'autres laboratoires. Avant chaque réglage de la réaction, la suspension est bien mélangée et examinée au microscope avec un condenseur à fond noir pour déterminer sa densité. Pour fixer RIF-abs, il est nécessaire d'avoir une suspension contenant 40-60 tréponèmes dans le champ sombre, en présence d'une suspension plus épaisse, il faut la diluer.
En tant que sorbant pour RIF-abs, un antigène tréponémique à ultrasons pour RSK, produit par l'entreprise Kaunas pour la production de préparations bactériennes du ministère de la Santé de l'URSS, peut être utilisé. Il s'agit d'une suspension d'un mélange de souches de tréponème pâle cultivées V, VII, VIII, IX et Reiter, détruites par ultrasons. Chaque lot de sorbant doit être titré avant d'être utilisé dans RIF-abs à des fins de diagnostic.
Titrage de sorbant
Les sorbants sont titrés sur les sérums sanguins de patients atteints de syphilis, donnant un résultat positif net (4+) et faiblement (2+) dans le RIF à une dilution de 1:5, ainsi que sur les sérums sanguins de personnes indemnes de syphilis infection, donnant un résultat négatif en RIF-5 et une positivité non spécifique (2+ ou plus).
Un exemple de détermination du titre d'un sorbant
L'ensemble du sorbant est dilué avec du tampon phosphate, pH = 7,2, 2, 3, 4 fois ou plus. Prélevez 3 sérums sanguins de patients atteints de syphilis, dont l'un donne un résultat fortement positif (4+) pour RIF-5, 2 - un résultat faiblement positif (2+) et 5 sérums sanguins de personnes indemnes d'infection syphilitique, dont 3 donner des résultats non spécifiques et RIF-5 (2+ et plus). Tous les sérums sanguins sont dilués 5 fois avec un sorbant, dilués tour à tour 2, 3, 4 fois et plus avec du tampon phosphate. Ensuite, le sérum sanguin est examiné dans la réaction. Après avoir pris en compte les résultats, une dilution de sorbant est sélectionnée, dans laquelle les sérums sanguins sorbés de patients atteints de syphilis conservent un degré de positivité similaire à celui obtenu avec des sérums sanguins dilués avec du tampon phosphate, et le sérum sanguin de personnes indemnes d'infection syphilitique. n'émet pas de luminescence. Cette dilution du sorbant est son titre.
Le titre du sorbant dans ce cas était une dilution de 1: 3, dans laquelle tous les sérums sanguins de patients atteints de syphilis conservaient le degré de positivité obtenu dans le contrôle, et en même temps, la positivité non spécifique des sérums sanguins non syphilitiques était supprimé de manière fiable.
Sérum luminescent anti-espèces
Pour étudier le sérum humain dans RIF-abs, un sérum sanguin marqué au fluorochrome d'animaux immunisés avec des protéines sériques humaines est nécessaire. Le sérum luminescent lyophilisé est dissous dans des conditions de stérilité dans de l'eau distillée dans le volume indiqué sur l'étiquette de l'ampoule, versé dans un tube stérile avec un bouchon en caoutchouc et conservé à 4°C pendant 1-2 mois pendant l'utilisation.
Le jour de la réaction, la quantité nécessaire de ce sérum est diluée par titre avec de l'eau distillée. La dilution de travail du sérum indiquée sur l'étiquette n'est pas adaptée à la mise en scène d'une réaction à des fins de sérodiagnostic de la syphilis, c'est pourquoi le titre de chaque lot doit être à nouveau déterminé.
Tableau N 13
Résultats du titrage du sorbant
| Tester le sérum | Résultats RIF-5 | |||
| Dilution du sérum sanguin 1: 5 avec du tampon (K) | Dilution du sérum sanguin 1: 5 avec sorbant en dilution | |||
| 1: 2 | 1: 3 | 1: 4 | ||
| Sérum sanguin d'un patient atteint de syphilis | ||||
| N 1 | 4+ | 3+ | 4+ | 4+ |
| N 2 | 2+ | 1+ | 2+ | 2+ |
| N 3 | 2+ | 2+ | 2+ | |
| Sérum sanguin non syphilitique | ||||
| N 1 | 3+ | 1+ | 2+ | |
| N 2 | 2/3+ | 2+ | ||
| N 3 | 2+ | 2+ | ||
| N 4 | 2+ | 2+ | ||
| N 5 | ||||
Titrage de sérum luminescent anti-espèce
Prélever 5 sérums sanguins de patients atteints de syphilis et 5 sérums sanguins de personnes saines, les diluer 5 fois avec un sorbant (en tenant compte de son titre) et mettre en place une réaction en utilisant en phase II différentes dilutions de sérum luminescent contre les globulines sériques humaines de la série dont le titre est déterminé. Il est à noter que le titre des sérums luminescents actuellement produits par l'I.E. NF Gamalei, fluctue lorsque RIF-abs est réglé de 1: 100 à 1: 140. Lors de la prise en compte de la réaction, le titre préliminaire de sérum luminescent doit être considéré comme la dilution, lorsqu'il est utilisé avec des sérums sanguins positifs, une bonne fluorescence des tréponèmes a été obtenu, et avec une fluorescence négative de l'antigène non reçu. Une dilution du sérum luminescent supérieure au titre conduit à une diminution de la sensibilité de la réaction, et une dilution plus faible conduit à une diminution de la spécificité. Après détermination du titre préliminaire, il convient de le préciser sur un plus grand nombre de sérums sanguins positifs et négatifs. Le titre final peut être considéré comme celui qui a été testé sur 100 sérums sanguins, et parmi ceux-ci, au moins 20 devraient provenir de patients atteints de syphilis.
Pour éviter la germination après dilution du sérum luminescent sec avec de l'eau distillée, il faut y ajouter du morthiolate à raison de 1 volume de sa solution 1 : 1000 à 9 volumes de sérum luminescent. Lors de la prise de nouvelles ampoules de la même série, le titre ne doit être vérifié et spécifié que pour 10 sérums sanguins manifestement positifs et négatifs.
Exemple de détermination du titre préliminaire d'un sérum anti-espèce luminescent
Préparez 60 préparations, numérotées de 1 à 60. Prélevez 10 sérums sanguins - 5 de patients atteints de syphilis, 5 de personnes en bonne santé. Tous les sérums sanguins sont dilués 5 fois avec un sorbant dilué au titre.
Sur les préparations numérotées 1-10, 11-20, 21-30, 31-40, 41-50, 51-60, dans la première phase de la réaction, les mêmes 10 sérums sanguins dilués 5 fois avec le sorbant sont appliqués. Dans la phase II de la réaction pour 1-10 préparations, du sérum luminescent est appliqué, dilué 1: 100, à 11-20 1: 110, à 21-30 - 1: 120, à 31-40 - 1: 130, à 41-50 - 1 : 140, à 51-60 - 1 : 150.
Technique de stadification RIF-abs
A partir de l'antigène, les préparations sont préparées sur des lames de verre fines et bien dégraissées, au dos desquelles des cercles de 0,7 cm de diamètre sont marqués au coupe-verre (10 cercles sur 1 lame de verre). A l'intérieur du cercle, une suspension antigénique de tréponèmes pâles est appliquée sur le verre. Avec l'extrémité scellée d'une pipette Pasteur, la suspension est répartie dans un mouvement circulaire à l'intérieur du cercle, séchée à l'air et fixée pendant 10 minutes dans de l'acétone chimiquement pure. Ensuite, les médicaments sont numérotés. Les sérums sanguins à tester inactivés sont dilués 5 fois avec un sorbant dilué par titre avec une solution tampon. Une rangée de tubes est placée dans un portoir dont le nombre et le nombre correspondent au nombre et au nombre de sérums sanguins testés. Le sorbant dilué au titre est versé dans des tubes à essai avec une pipette, 0,2 ml, puis 0,05 ml de sérum sanguin total à tester est ajouté et bien mélangé. La dilution du sérum sanguin peut être effectuée avec l'appareil Florinsky. Le sérum sanguin dilué avec le sorbant est appliqué sur l'antigène de manière à recouvrir uniformément le frottis, et les préparations sont placées dans une enceinte humide, qui est fermée par un couvercle et placée dans un thermostat à 37° pendant 30 minutes (phase réactionnelle JE). Après la première phase, les préparations sont soigneusement lavées dans 2 portions de tampon phosphate, et dans la deuxième portion les préparations sont placées pendant 10 minutes, séchées, après quoi elles sont à nouveau placées dans une chambre humide, du sérum luminescent dilué par titre est appliqué et laissé à température ambiante pendant 30 minutes (réactions en phase II). A la fin de la deuxième phase, les préparations sont lavées avec du tampon phosphate, comme décrit ci-dessus, séchées et appliquées à la surface des frottis avec une goutte d'huile à immersion non luminescente (phtalate de diméthyle).
L'étude des préparations est réalisée au microscope à fluorescence avec une lampe mercure-quartz DRSH-250 avec un système d'immersion, un oculaire 4X ou 5X, des filtres SZS-7 ou 14, FS-1. BS-8 et ZhS-18 ou T-2N. La réaction est prise en compte en évaluant la luminescence des tréponèmes pâles. Le sérum sanguin est considéré comme positif dans RIF-abs s'il donne une lueur pour 4+, 3+ et 2+. Une lueur verte-jaune brillante est classée 4+, une lueur brillante est classée 3+ et une lueur faible est 2+. Les sérums sont considérés comme négatifs s'ils donnent un éclat 1+ (les tréponèmes de la préparation sont colorés plus intensément que le fond) ou ne le donnent pas.
Dans chaque réglage de RIF-abs, les commandes suivantes doivent être utilisées :
Contrôle fortement positif. Sérum sanguin d'un patient atteint de syphilis, qui donne un éclat de 4+ lorsqu'il est dilué avec du tampon 5 fois. Lorsqu'il est dilué 5 fois avec un sorbant, le sérum sanguin ne doit pas perdre son degré de positivité de plus de 1+.
Contrôle faiblement positif. Sérum sanguin entier ou dilué d'un patient atteint de syphilis, donnant faible degré luminescence de l'antigène de 2+ lorsqu'il est dilué avec du tampon 5 fois. Lorsqu'il est dilué avec un sorbant, sa positivité doit être préservée.
Contrôle non spécifique. Sérum sanguin non syphilitique qui, dilué avec un tampon, a une fluorescence d'au moins 2+. Lorsqu'il est dilué avec un sorbant, sa positivité doit être éliminée.
Les contrôles de l'antigène, du sorbant et du sérum luminescent ne peuvent être définis qu'en cas d'utilisation de nouvelles séries de ces ingrédients.
Méthode de réglage des RIF-abs avec du sang capillaire
Le réglage RIF-abs est possible non seulement avec du sérum sanguin, mais aussi avec du sang prélevé sur un doigt. Cette modification du RIF-abs peut être utilisée lors de l'examen des enfants pour la syphilis, lorsqu'il est difficile d'obtenir du sang d'une veine chez les adultes, lors d'un examen de masse de divers contingents pour la syphilis.
Lors de la mise en place de RIF-abs avec du sang, les mêmes ingrédients de réaction sont utilisés que lors de la mise en place de RIF-abs avec du sérum sanguin (antigène, sorbant, sérum luminescent). Le titre de sérum luminescent est déterminé selon le schéma ci-dessus, mais lorsqu'une réaction avec du sang est effectuée. Après la perforation du doigt du patient, le sang pour examen est prélevé avec une micropipette jusqu'à la marque de 0,1 ml, rapidement soufflé dans un tube à essai contenant 0,3 ml d'eau distillée, soigneusement mélangé avec une pipette et filtré à travers un filtre en papier humidifié avec de l'eau distillée . La mise en place d'une réaction avec du sang dilué est possible à la fois le jour de sa prise et après 1-2 jours, à condition qu'elle soit conservée à 4 °.
Immédiatement avant de mettre en scène la réaction, 0,1 ml du sorbant entier est ajouté à tous les échantillons de sang inclus dans la réaction, mélangé avec une pipette et agité, placé dans un thermostat à 37° pendant 30 minutes. Ensuite, le sang traité avec le sorbant est appliqué sur des frottis d'antigène et placé dans une chambre humide à 37° (1 phase de la réaction). Après l'expiration de la période d'exposition, les préparations sont lavées dans la première portion de tampon phosphate afin qu'il n'y ait aucune trace de sang sur les lames et elles sont placées dans la deuxième portion du tampon pendant 10 minutes. Après séchage des frottis, la phase II de la réaction est réalisée. Dans ce cas, du sérum luminescent contre les globulines humaines, dilué par le titre établi pour cette modification du RIF, est appliqué sur les préparations. Les lames en chambre humide sont à nouveau placées dans un thermostat à 37°.
Après 30 minutes, les préparations sont à nouveau lavées dans 2 portions de tampon phosphate pendant 10 minutes, séchées et montées pour la microscopie à fluorescence. L'étude des médicaments et l'enregistrement des résultats de la réaction sont effectués de la même manière que lors de la mise en place de RIF-abs avec du sérum sanguin.
Technique de réglage RIF-200
Les techniques de réglage RIF-abs et RIF-200 sont similaires. Lors du réglage de RIF-200, le traitement des sérums sanguins testés, la préparation de l'antigène, la préparation du sérum luminescent anti-espèce et son titrage sont effectués de la même manière que lors du réglage de RIF-abs. Il faut seulement tenir compte du fait que les titres du sérum luminescent produit à l'heure actuelle dans le RIF-200 vont de 1:20 à 1:50.
Technique de mise en scène RIF-200
Les sérums sanguins testés sont dilués 200 fois avec du tampon phosphate. Pour cela, 3 rangées de tubes à essai sont placées dans un rack dont le nombre et la numérotation dans chaque rangée correspondent au nombre et à la numérotation des sérums sanguins testés dans le cahier de travail. Dans la première rangée, des sérums de sang total à tester sont versés, dans la deuxième rangée, 0,45 ml de tampon sont versés dans les tubes, dans la troisième - 0,95 ml de tampon. Dans la deuxième rangée, une dilution de 10 fois de sérum sanguin est préparée, pour laquelle 0,05 ml de sérum sanguin à tester est prélevé dans chaque tube de la première rangée avec une pipette graduée séparée de 1 ml, transféré dans le tube correspondant du deuxième rangée et mélangé avec le tampon disponible là-bas. À partir de chaque tube à essai de la deuxième rangée avec la même pipette, transférez 0,05 ml du sérum sanguin à tester dilué déjà 10 fois dans le tube à essai correspondant de la troisième rangée et obtenez une dilution de 200 fois.
Lors de la mise en scène d'une réaction à des préparations placées en chambre humide, des sérums sanguins tests dilués 200 fois sont appliqués de manière à ce que leurs numéros indiqués sur les éprouvettes correspondent aux numéros sur les lames de verre. Après application sur des préparations de sérum sanguin, la chambre humide est placée pendant 30 minutes dans un thermostat à une température de 37° (phase I de la réaction). Puis les préparations sont lavées 10 minutes dans 2 portions de tampon et séchées. Après cela, ils sont à nouveau placés dans une chambre humide et du sérum luminescent dilué par titre est appliqué sur le tout (phase II de la réaction). La deuxième phase est réalisée pendant 30 minutes à température ambiante, après quoi les préparations sont lavées pendant 10 minutes, séchées et montées pour la microscopie à fluorescence.
Les résultats du RIF-200 sont pris en compte au même titre que le RIF-abs.
Dans le cas où les cliniciens s'intéressent au titre des anticorps fluorescents dans le sérum sanguin du patient, RIF-abs et RIF-200 doivent être réglés avec une dilution séquentielle des sérums sanguins testés et le titre des anticorps fluorescents pour considérer la dilution la plus élevée de sérum sanguin qui donne toujours un résultat de réaction positif. Le titre est généralement désigné par un nombre caractérisant le degré de dilution du sérum sanguin testé, par exemple 5, 10, 20, 40, etc. (RIF-abs) ou 200, 400, 800, etc. (RIF-200).
Lors de la mise en scène des deux modifications de la réaction pour la dilution des sérums sanguins testés et pour le lavage des préparations après les phases I et II, il convient d'utiliser un tampon phothatique de composition suivante : 1 l d'eau distillée, 6,8 g de chlorure de sodium, 1,48 g de disubstitué acide phosphorique sodique, 0,43 g de phosphate de potassium monosubstitué (pH = 7,2). La solution préparée est conservée à température ambiante pendant pas plus d'une semaine.
En raison de la possibilité d'obtenir des résultats négatifs en présence d'anticorps fluorescents, le sang et le sérum ne doivent pas être examinés dans RIF-abs et RIF-200 pendant le traitement de patients par pénicilline.
Méthodologie de mise en place de RIF-c
Le diagnostic précoce des lésions du système nerveux dans la syphilis est un enjeu urgent dans la lutte contre cette maladie. En raison du fait que le RIF-c a une plus grande sensibilité que tous les autres tests utilisés pour le diagnostic alcoolique de la syphilis, cette modification du RIF peut être recommandée pour le diagnostic des lésions syphilitiques du système nerveux central dans toutes les formes de syphilis.
Pour la fixation de RIF-c, le même antigène, le sérum luminescent, est utilisé que pour la fixation de RIF-abs et de RIF-200 avec du sérum sanguin. La détermination des anticorps fluorescents dans le liquide céphalo-rachidien et le sérum sanguin et la prise en compte de la réaction sont également similaires.
Le liquide céphalo-rachidien est introduit dans la réaction non inactivé et entier. Avant de régler la réaction, il peut être conservé dans le compartiment congélateur du réfrigérateur dans des tubes à essai sous des bouchons en caoutchouc jusqu'à 2 semaines. La décongélation s'effectue à température ambiante.
Technique de mise en scène RIF-c
Dans la phase I de la réaction, 0,05 ml de liquide céphalo-rachidien test non dilué est appliqué sur l'antigène, les préparations sont placées dans une enceinte humide pendant 30 minutes à température ambiante. Puis elles sont lavées avec du tampon phosphate pH = 7,2 pendant 10 minutes, séchées. En phase II, un sérum luminescent dilué par titre est appliqué sur les préparations, qui est titré lors de la mise en réaction avec liquide cérébro-spinal... Les préparations sont conservées à température ambiante pendant 30 minutes dans une chambre humide, lavées, séchées et montées pour la microscopie à fluorescence.
Sources d'erreurs
1. Non-respect des conditions de préparation, de stockage des réactifs et de réglage de la réaction.
2. Mauvaise qualité du sérum luminescent et détermination inexacte de son titre.
3. Application du matériau à tester ou du sérum luminescent lors de la mise en place d'une réaction non pas au médicament, mais de l'autre côté de la lame.
4. Réglage incorrect de l'éclairage dans un microscope à fluorescence.
5. Antigène de faible qualité.
L'analyse de la syphilis est effectuée à l'aide de diverses méthodes de détection de l'agent pathogène. Avec le développement de la pathologie, un grand nombre de signes spécifiques apparaissent, par conséquent, afin d'établir un diagnostic précis, une personne malade est examinée de manière globale. Analyse générale le sang n'est pas très informatif, il n'est pas utilisé pour diagnostiquer cette infection vénérienne.
Types de recherche et biomatériaux à analyser
Diverses techniques et biomatériaux sont utilisés pour identifier la maladie. Aux premiers stades, la syphilis est déterminée à l'aide d'un test bactérioscopique. Les échantillons sont examinés au microscope. L'appareil vous permet de détecter les souches de l'agent pathogène. Plus tard, ils effectuent tests sérologiques du sang. Grâce à eux, des antigènes et des anticorps de la syphilis sont détectés dans les échantillons.
Les méthodes pour déterminer une infection génitale sont divisées en 2 catégories :
- Direct, révélant un micro-organisme pathogène. Ceux-ci incluent : la microscopie à fond noir, l'analyse RIT (infection de lapins avec du biomatériau pour la recherche), Méthode PCR- réaction en chaîne par polymérase (avec son aide, les éléments génétiques de l'agent pathogène sont trouvés).
- Indirect (sérologique) détecte les anticorps dirigés contre l'agent pathogène. Ils sont produits système immunitaire en réponse à une infection.
Les techniques sérologiques sont divisées en 2 catégories : tréponémiques et non tréponémiques.
- Non tréponémique, y compris : test au rouge de toluidine, analyse RSK, test RPR, test sanguin par méthode rapide du cancer de la vessie.
- Tréponémique, comprenant : immunoblot, test RSK, analyse RIT, étude RIF, test RPGA, analyse ELISA.
Le contenu informatif des tests d'infection est différent. Le plus souvent, ils effectuent les principaux types de tests pour la syphilis, qui incluent des méthodes sérologiques.
Biomatériau pour la recherche
Pour identifier le tréponème pâle, un agent pathogène qui ressemble à une spirale et provoque la syphilis, des échantillons sont prélevés :
- sang veineux;
- liquide céphalo-rachidien (sécrétion du canal rachidien);
- le contenu des ganglions lymphatiques;
- tissu d'ulcération.
S'il est nécessaire d'effectuer des tests de détection de la syphilis, le sang provient non seulement de la veine cubitale, mais également du doigt. Le choix du biomatériau et de la méthode de recherche est influencé par la gravité de l'évolution de l'infection et l'équipement du centre de diagnostic.
Recherche directe
L'identification d'agents infectieux au microscope est une preuve convaincante de la syphilis. De cette façon, un agent pathogène est trouvé chez 8 patients sur 10. Un résultat négatif chez les 2 patients restants ne signifie pas qu'ils ne sont pas infectés.
L'étude est réalisée aux stades primaire et secondaire (stade) de la maladie, qui se caractérise par l'apparition d'éruptions cutanées et de syphilis (ulcération) sur les tissus épithéliaux ou les muqueuses. Les agents pathogènes qui causent les maladies vénériennes se trouvent dans l'écoulement des lésions.
Plus précisément, un test complexe, noté RIF - la réaction d'immunofluorescence, répond à la définition des tréponèmes. L'échantillon pour la recherche est prétraité avec des anticorps fluorescents. Les composés capables de briller se collent aux bactéries. En examinant des échantillons au microscope, en cas d'infection, l'assistant de laboratoire voit des agents pathogènes scintillants.

Le test est utilisé pour le diagnostic précoce de la maladie. Plus la maladie dure longtemps, plus la sensibilité des méthodes de recherche est faible. De plus, il diminue après le traitement des éruptions cutanées et des ulcères avec des antiseptiques et chez les patients ayant subi un traitement. Parfois, la recherche donne des résultats faussement négatifs et faussement positifs.
L'analyse RIT est une méthode très précise pour détecter la syphilis. Lors d'un test, les résultats doivent attendre longtemps. Jusqu'à ce que le lapin infecté montre des signes d'infection. Le test est très rarement utilisé, malgré le fait qu'il soit super précis.
En utilisant réaction en chaîne par polymérase pour la syphilis, les éléments génétiques des agents pathogènes sont déterminés. Le seul inconvénient de la PCR est son coût élevé.
Tests non tréponémiques
Ces tests sanguins aident à détecter les anticorps qui apparaissent en réponse à la cardiolipine, un composé lié à la structure générale des membranes des agents pathogènes.
Réaction de Wasserman (PB ou RW)
L'étude la plus connue pour la syphilis est la réaction de Wasserman. Le RV est inclus dans la catégorie des réactions de fixation du complément (CAC). Les nouvelles méthodes RSC présentent des différences significatives par rapport à la RW traditionnelle. Mais ils sont désignés, comme précédemment, par le concept de « réaction de Wasserman ».
Le système immunitaire synthétise des anticorps (marqueurs) en réponse à l'invasion de tréponèmes. Ils sont détectés dans un test sanguin pour la syphilis en utilisant la méthode de réaction de Wasserman. Un résultat RW positif confirme que le sujet est infecté.

Réaction d'hémolyse - indice d'analyse RV. Avec elle, 2 substances interagissent : le sérum hémolytique et les érythrocytes de bélier. Le sérum est fabriqué en immunisant un lapin avec des érythrocytes de bélier. L'activité du fluide biologique est réduite par chauffage.
Les indicateurs du VD dépendent de la disparition ou non de l'hémolyse. L'hémolyse se produit dans l'échantillon sans marqueurs. Dans ce cas, une réaction aux antigènes est impossible. Le complément est dépensé en interaction avec les érythrocytes de mouton. Lorsqu'il y a des marqueurs dans l'échantillon, le compliment réagit avec les antigènes. Dans ce cas, l'hémolyse ne se produit pas.