EPIDEMIOLOGIE, DIAGNOSTIC ȘI METODE DE TRATAMENT
Rolul etiologic al bacteriilor în dezvoltarea ulcerelor peptice a fost sugerat de mult timp. În 1893, au început mai întâi să vorbească despre descoperirea spirochetelor în stomacul animalelor, iar în anii 1940, aceste microorganisme au fost găsite în stomacul persoanelor care suferă de ulcer peptic sau cancer al acestui organ.
Abia în 1983 a fost confirmată prezența unei relații patogenetice între infecția bacteriană și ulcerul peptic.
Cercetătorii Robin Warren și Barry Marshall din Australia au raportat prezența bacteriilor în formă de spirală, pe care le-au obținut ulterior într-un mediu de cultură, la pacienții cu gastrită cronică și ulcer peptic. Inițial, se credea că aceste bacterii aparțin genului Campylobacter, dar mai târziu au fost atribuite unui nou gen separat. Din 1989, acest microorganism a fost numit Helicobacter pylor (HP) în întreaga lume.
BIOLOGIA MICROORGANISMULUI
HP este o bacterie gram-negativă microaerofilă de formă curbată sau spirală, cu mulți flageli. Se găsește în adâncurile gropilor gastrice și pe suprafața celulelor epiteliale, în principal sub stratul protector de mucus care acoperă mucoasa gastrică. În ciuda acestui mediu neobișnuit, nu există concurență pentru Hp din alte microorganisme.
PH-ul habitatului Нр este aproximativ egal cu 7, concentrația de oxigen este scăzută și conținutul nutrienți destul de suficient pentru viața microbului.
VIRULENŢĂ
Astăzi, sunt cunoscuți câțiva factori de virulență care permit Hp să colonizeze și apoi să persiste în corpul gazdei:
Forma în spirală și prezența flagelilor
Prezența enzimelor de adaptare
Adezivitate
Suprimarea sistem imunitar.
Forma spirală și prezența flagelilor
Forma spirală a Нр este bine adaptată mișcării în stratul vâscos al mucusului gastric, ceea ce permite microorganismului să colonizeze complet membrana mucoasă. În plus, prezența flagelilor acoperiți face posibilă mișcarea rapidă atât în sucul gastric, cât și în mucus.
Enzime de adaptare
HP produce enzime - urează și catalază. Ureza conținută în sucul gastric catalizează ureea în dioxid de carbon (CO2) și ion amoniu (NH4 +), care neutralizează și mai mult pH-ul mediului imediat al microbului și protejează HP de acțiune bactericidă acid clorhidric al stomacului. Astfel, microorganismul, conservat în sucul gastric, pătrunde în stratul protector de mucus de pe suprafața epiteliului gastric.
Eliberarea catalazei și, eventual, a superoxidului dismutosmutazei, permite Hp să suprime răspunsul imun al gazdei. Aceste enzime catalizează transformarea compușilor bactericidi ai oxigenului eliberați de neutrofilele activate ca urmare a infecției în substanțe inofensive, cum ar fi oxigenul și apa.
Adezivitate
Capacitatea Hp de a se atașa la componentele oligozaharidice ale fosfolipidelor și glicoproteinelor specifice de pe membranele celulelor epiteliale gastrice determină colonizarea selectivă a acestor celule secretoare de mucus. În unele cazuri, aderența duce la formarea unei structuri caracteristice numite „piedestal”. În acele locuri în care membranele celulelor bacteriene sunt adiacente unele cu altele, se observă distrugerea microviliilor și ruperea componentelor citoscheletului. Alți receptori posibili de legare a Hp sunt componentele matricei extracelulare, cum ar fi laminina, fibronectina și tipuri diferite colagen.
Se crede că doar o proporție foarte mică de microorganisme (mai puțin de 10%) prezente în stomac se află într-o stare legată la un moment dat. Nu există un singur punct de vedere cu privire la necesitatea adeziunii Нр și dacă adeziunea nu este O condiție prealabilă colonizarea mucoasei gastrice, atunci aceasta, aparent, poate fi considerată ca o etapă extrem de importantă în dezvoltarea bolii.
Suprimarea sistemului imunitar
HP stimulează sistemul imunitar al gazdei să producă anticorpi sistemici. Cu toate acestea, după cum arată rezultatele cercetărilor, microorganismele sunt capabile să suprime răspunsurile imune celulare.
Apărarea organismului împotriva infecției este efectuată de fagocite, care sunt capabile să captureze și să digere substanțe străine inclusiv bacteriile. În condiții normale, fagocitele nu pot trece prin mucoasa gastrică, dar dacă acest lucru se întâmplă totuși, hemaglutininele de pe suprafața celulelor HP pot inhiba procesul de aderență sau fagocitoză de către leucocitele polimorfonucleare. În plus, amoniacul produs de HP este capabil să deterioreze membranele fagocitelor. După cum sa menționat deja, activitatea catalizei Hp îi permite să evite efectele distructive ale neutrofilelor.
Lipopolizaharidele (LPS) acționează ca o barieră hidrofilă asociată cu suprafața celulelor bacteriene. LPS Hp s-a format în timpul evoluției pentru a proteja împotriva unui răspuns imun hiperactiv, care permite microorganismului să supraviețuiască în stomac. LPS Hp prelevat de la pacienții cu ulcer este capabil să stimuleze secreția de pepsinogen, ducând la un exces de pepsină, care este un factor de risc în dezvoltarea bolii ulcerului peptic.
Patogenitate
Există mai multe mecanisme prin care HP determină dezvoltarea bolii:
Toxine și enzime toxice
Stimularea inflamației
Schimbarea fiziologiei stomacului
Toxine și enzime toxice
Citotoxine
Aproximativ 65% din tulpinile de Hp produc citotoxină vacuolizantă (Vac A), care favorizează formarea de vacuole în celulele epiteliale, ceea ce duce la moartea lor. Aproape toți pacienții cu ulcer duodenal sunt infectați cu tulpina HP care formează Bac A. Activitatea citotoxică este mai mare la acele microorganisme care au fost obținute de la pacienții cu ulcer duodenal, comparativ cu cele care au fost luate de la persoane fără boală ulcerului peptic. Tulpinile de Hp care formează Vac A produc, de asemenea, proteine asociate cu citotoxină (TsagA). Anticorpii împotriva TsagA au fost găsiți în serul aproape tuturor pacienților cu carcinom și ulcer gastric.
Ureaza
În plus față de factorul de virulență, activitatea ureazei poate fi asociată cu efectele toxice ale amoniacului produs. În concentrații mari, amoniacul provoacă vacuolizarea celulelor epiteliale, similar cu cel observat atunci când este expus la toxina vacuolizantă Hp.
Fosfolipazele A2 și C
Membranele celulelor epiteliului gastric sunt compuse din două straturi de fosfolipide. Ca urmare a acțiunii fosfolipazelor A2 și C, produse de Hp, se observă modificări in vitro la acestea.
Fosfolipazele din bacteriolizate transformă suprafața hidrofobă a biostratului fosfolipidic într-o stare hidrofilă „umedă”. Astfel, ca urmare a acțiunii acestor enzime bacteriene, integritatea membranelor celulelor epiteliale și rezistența lor la deteriorare, de exemplu, la acidul clorhidric gastric, este perturbată.
Fosfolipazele pot interfera, de asemenea, cu funcția de protecție a mucusului gastric. Hidrofobicitatea și vâscozitatea mucusului sunt în mod egal dependente de conținutul de fosfolipide din acesta. În prezența Hp, mucusul devine mai puțin hidrofob, în timp ce vâscozitatea acestuia scade. Aceste modificări pot duce la faptul că o cantitate mare de ioni de hidrogen pătrunde în membrana mucoasă din lumenul stomacului, ceea ce cauzează deteriorarea acestuia.
Stimularea inflamației
Reacția inflamatorie care apare în corpul gazdei ca răspuns la introducerea de Hp în sine contribuie la perturbarea integrității epiteliului gastric. Proteinele chemotactice eliberate de Hp atrag un număr mare de neutrofile, celule limfatice și monocite. Deci, prezența unui număr mare de neutrofile în epiteliul stomacului este tipică pentru infecția cu HP. Celulele mononucleare eliberează interleukine, factori de necroză tumorală și radicali superoxizi. Interleukinele și factorii de necroză tumorală împiedică celulele mononucleare să migreze departe de locul reacției inflamatorii. În plus, ele declanșează formarea de radicali superoxizi, care sunt apoi convertiți în alți metaboliți intermediari activi ai oxigenului care sunt toxici atât pentru celulele Hp, cât și pentru celulele mucoasei.
Alți mediatori inflamatori asociați cu infecția cu HP par a fi fosfolipaza A2 și factorul de activare a trombocitelor (PAF). Fosfolipaza A2 este implicată în descompunerea fosfolipidelor din membranele celulare ale organismului gazdă, ceea ce duce la formarea de compuși care provoacă chimiotaxia celulelor inflamatorii, precum și perturbarea permeabilității membranei. PAF poate provoca, de asemenea, modificări patologice grave, în special, ulcerații gastrice, iar precursorii PAF se găsesc în specimenul de biopsie al stomacului la pacienții cu ulcere duodenale Hp-pozitive.
Schimbarea fiziologiei stomacului
Gastrin - hormon peptidic secretat de celulele G antrale. O creștere a nivelului de gastrină serică la pacienții cu ulcere duodenale Hp-pozitive duce la o creștere a secreției de acid fie printr-o creștere directă a producției de celule parietale, fie printr-o creștere a numărului de celule parietale.
O creștere a eliberării gastrinei de către antrul stomacului ca urmare a infecției cu HP are loc din următoarele motive:
Amoniacul, format sub influența ureei Hp, crește pH-ul stratului mucos al epiteliului gastric, interferând astfel cu mecanismul fiziologic al părereîntre secreția de gastrină și acidul clorhidric gastric.
· Inflamarea mucoasă la persoanele infectate cu Hp poate stimula secreția de gastrină.
· Somatostatina, secretată de celulele D ale antrului, inhibă sinteza și secreția gastrinei de către celulele G. Studiile efectuate cu participarea persoanelor infectate cu Hp au relevat o scădere a concentrației de somatostatină antrală.
Conținutul de pepsinogen din sânge este, de asemenea, crescut la pacienții Hp pozitivi cu ulcere duodenale. Pepsinogenul este produs de celulele formatoare de acid ale membranei mucoase ale fundului stomacului și este secretat atât în lumenul său, cât și în sânge. Pentru formarea unei enzime proteolitice - pepsina - este necesar să se activeze precursorul acesteia în conținutul acid al stomacului. O creștere a nivelului seric de pepsinogen I este factor important riscul de a dezvolta ulcere duodenale, acest lucru apare la 30-50% dintre pacienți.
Epidemiologie
Infecția cu HP apare de obicei în copilărie și, dacă este netratată, persistă în corp pe termen nelimitat. Incidența infecției cu HP în rândul copiilor cu vârsta cuprinsă între 2 și 8 ani în țările în curs de dezvoltare este de 10% pe an și ajunge la aproape 100% până la vârsta adultă. În țările dezvoltate, prevalența Hp crește și odată cu vârsta, dar infecția la copii este relativ scăzută.
În plus față de vârstă, statutul socio-economic este un factor epidemiologic important al HP. În general, cu cât statutul socio-economic al populației este mai mic, cu atât este mai mare riscul de infecție. Se presupune că predominanța populației de copii în societate este singurul factor de risc semnificativ, în timp ce furnizarea de apă potabilă curată și respectarea standarde sanitare sunt, de asemenea, importante în prevenirea infecției cu Hp.
Pe baza rezultatelor mai multor studii, experții au concluzionat că factorul ocupațional influențează prevalența Hp. S-a dovedit că lucrătorii abatorului (contactul cu animalele infectate) și gastroenterologii sunt grupuri cu risc ridicat.
2.6. Căi de transmisie
Rezervorul natural al HP este în primul rând omul, dar infecția se găsește și la pisicile domestice, maimuțele neumane și porcii. Există două căi posibile de transmitere: fecal-orală și, într-o măsură mai mică, orală-orală.
Traseul fecal-oral
· Prin apa potabilă contaminată (HP poate supraviețui până la 2 săptămâni în apele reci ale mării și ale râurilor).
· Când mâncați legume crude irigate cu apă uzată netratată.
Calea oral-orală
· Există dovezi ale unei rate ridicate de supraviețuire a Hp pe placă și salivă.
· Ca urmare a ingestiei de vărsături; HP este capabil să persiste o perioadă de timp în suc gastric.
· Cel mai puțin frecvent - cu endoscoape insuficient dezinfectate și pensă de biopsie (transmisie iatrogenă).
Reinfectarea
Recurența ulcerelor duodenale după terapia de eradicare a HP este adesea asociată cu reinfecție (reinfecție).
Din rezultatele studiilor privind frecvența reinfectării în primul an după tratamentul adecvat (pacienții au fost reexaminați la fiecare 12 luni), rezultă că variază de la 0 la 35%. Rata anuală de reinfecție tinde să scadă la 3% și mai puțin după primul an.
Cifrele mai mari pentru frecvența reinfectării în primul an, citate de un număr de cercetători, pot fi explicate prin faptul că au observat o reinfecție falsă, adică o exacerbare a infecției „vechi”. Se poate observa o reinfecție falsă:
Când, după terapia de eradicare, rămâne un număr mic de microorganisme, dar nu sunt detectate în timpul examinării de control.
· Ca urmare a reținerii Нр în alte părți ale tractului gastro-intestinal (de exemplu, pe placa dentară, în salivă sau fecale), ceea ce duce la autoinfecția stomacului.
BOLI ASOCIATE CU HELICOBACTER PYLORI
Hp se găsește la persoanele cu următoarele condiții:
Ulcer peptic (ulcer peptic; ulcer)
Gastrită
Dispepsie non-ulcerată (NAD)
· Cancer la stomac
În prezent nu există dovezi convingătoare ale unei relații cauzale între Hp și dezvoltarea esofagitei de reflux, precum și ulcerelor induse de utilizarea medicamentelor antiinflamatoare nesteroidiene (AINS).
Ulcer peptic
90-100% dintre persoanele cu ulcer duodenal sunt infectate cu Hp.
Ulcerarea duodenală la indivizii Hp-negativi este de obicei rezultatul AINS sau o manifestare a sindromului Zollinger-Ellison.
În cazul ulcerului gastric, infecția cu Hp este aproape de 85%. Aportul AINS este un alt factor etiologic important al ulcerului gastric. Prevalența infecției cu Hp devine și mai mare dacă luăm în considerare doar un subgrup de persoane cu ulcer gastric care neagă administrarea de AINS. .
Cea mai convingătoare dovadă a rolului Hp în patogeneza ulcerului peptic este dinamica pozitivă în cursul bolii după terapia de eradicare. Administrarea de medicamente antisecretorii vindecă rapid și eficient ulcerele, dar imediat după sfârșitul aportului lor, se observă o recidivă.
Rezultatele numeroaselor studii confirmă faptul că, după vindecarea cu succes a ulcerului duodenal în primele 12 luni, recidiva este observată la aproximativ 80% dintre oameni, iar după 1-2 ani după terminarea tratamentului, ajunge la 100%.
După terapia de eradicare, recidiva apare la cel mult 10% dintre indivizi în decurs de 1 an de la terminarea terapiei
Gastrită
Cel mai adesea exacerbare gastrită cronică asociat cu Hp.
Ca răspuns la introducerea Hp, neutrofilele migrează în spațiile intraepiteliale și interstițiale, iar limfocitele, inclusiv celulele plasmatice, intră și aici. Într-o biopsie obținută în timpul unei exacerbări a gastritei, când neutrofilele se găsesc în cantități semnificative, Hp este detectat invariabil. Această formă de gastrită este mai des localizată în antr și se distinge prin cursul cel mai malign. În cazurile severe, poate fi implicat și corpul stomacului.
Dispepsie nonulcerată (NAD)
NUD este definit ca un sentiment recurent de disconfort epigastric, adesea asociat cu aportul alimentar fără prezența semnelor morfologice ale ulcerului peptic.
Conform statisticilor, NSA suferă de la 20 la 30% din populația lumii.
Rolul etiologic al Hp în NUD rămâne neclar, datele existente pe acest subiect sunt ambigue. Rezultatele numeroaselor studii indică o frecvență mai mare a detectării Hp la persoanele cu NUD comparativ cu cele care nu. Cu toate acestea, fiabilitatea rezultatelor majorității acestor studii este extrem de pusă la îndoială din cauza numărului insuficient de subiecți din grupurile de control.
Cancer la stomac
Există o corelație puternică între infecția cu Hp și dezvoltarea gastritei cronice. În gastrita cronică, se observă atrofia gastrică și metaplazia intestinală, care este o afecțiune precanceroasă. Cu toate acestea, detectarea Hp în probele de biopsie de cancer gastric este foarte problematică din cauza atrofiei severe a stomacului și a metaplaziei intestinale, în care este imposibil să se mențină populația microorganismului.
Cu toate acestea, studiile epidemiologice au arătat că prevalența Hp este adesea mai mare în regiunile cu o prevalență ridicată a cancerului de stomac.
Din rezultatele studiilor prospective, rezultă că persoanele cu infecție dovedită serologic prezintă un risc semnificativ mai mare de a dezvolta cancer de stomac.
Mai mult, studiile serologice au relevat infecția cu Hp din trecut la un număr mare de pacienți cu cancer gastric. Datorită prezenței unei conexiuni probabile între infecția cu Hp și dezvoltarea cancerului de stomac în 1994, experții OMS au plasat acest microorganism în clasa I de agenți cancerigeni (clasa agenților cancerigeni de încredere).
ÎNTREBĂRI DE DIAGNOSTIC ȘI TRATAMENT
DIAGNOSTIC
Testele de diagnostic care vizează detectarea Hp sunt rezumate în Tabelul 3.1.
Există două tipuri de teste, invazive și neinvazive. Pentru a confirma succesul terapiei de eradicare, aceste studii trebuie efectuate nu mai devreme de a cincea săptămână de la finalizarea acesteia.
Teste invazive
Toate aceste studii necesită gastroscopie cu biopsie gastrică și există trei metode pentru detectarea HP:
Cultural
Histologic
Test rapid de urează
Metoda culturală
Prezența chiar și a unei bacterii în biopsie duce la creșterea mai multor colonii, ceea ce permite stabilirea unui diagnostic precis. Culturile bacteriene sunt incubate într-un mediu microaerob la o temperatură de 370 C timp de 10 zile după care se efectuează identificarea microscopică sau biochimică a speciilor de bacterii crescute.
Metoda histologică
O examinare histologică va face posibilă stabilirea unui diagnostic precis, în special în combinație cu o metodă de cultură sau un test rapid de uree.
Trebuie avut în vedere faptul că rezultatele cercetării depind de experiența specialistului care le conduce. Specificitatea examenului histologic depinde de prezența altor tipuri de bacterii în specimenul de biopsie și de numărul de bacterii Hp.
Specimenul de biopsie este fixat în formalină. Când se utilizează, de exemplu, coloranți care conțin argint, în special colorantul Wartin-Starry, ambele țesuturi și microorganismul sunt colorate selectiv, ceea ce ajută la identificare. În cazul examinării microscopice a unei biopsii, de obicei sunt vizualizate mai multe câmpuri vizuale. Testarea cu mai multe medicamente crește sensibilitatea testului.
Test rapid de uree
Utilizat ca metodă de screening în timpul examinării endoscopice, testul ureazei vă permite să obțineți un rezultat într-o oră.
Când biopsia este incubată timp de 24 de ore, sensibilitatea testului crește.
Biopsia stomacului este incubată în mediu agar care conține uree. Dacă Hp este prezent în specimenul de biopsie, ureaza sa transformă ureea în amoniac, care schimbă pH-ul mediului și, în consecință, culoarea indicatorului. Sistemul de testare CLOtest ™ (testul Organismului asemănător cu Campylobacter, Delta West Ltd) permite efectuarea testului ureazei.
Teste neinvazive
Există 2 tipuri de metode neinvazive pentru detectarea unui microorganism:
Detectarea anticorpilor împotriva acestuia în fluidele biologice
Testul ureazei
DETECTAREA ANTICORPILOR LA Hp
Anticorpii produși ca răspuns la infecția cu Hp pot fi detectați în ser și plasmă, salivă și urină.
Această metodă este cea mai informativă pentru determinarea infecției cu un microorganism atunci când se efectuează studii epidemiologice mari. Aplicarea clinică Acest test este limitat de faptul că nu diferențiază infecția din istorie de prezența Hp în acest moment.
Există mai multe modificări ale acestui test și anume - ELISA(metoda imunosorbentă enzimatică), reacții de fixare a complementului, hemaglutinare bacteriană și pasivă, precum și metoda imunoblotării.
Balenele serologice comerciale includ Quick Vue ™ (Quidel Corporation), Helistal ™ (Cortecs Diagnostics), Helitest Lab ™ (Cortecs Diagnostics) și Pylori Tek ™ (Bainbridge Sciences, distribuitor al Diagnostic Products Corporation).
TEST DE UREASE
Prezența unei infecții cu Hp în stomac este determinată de activitatea ureazei specifice bacteriei. Pacientului i se administrează oral o soluție care conține 13C sau 14C uree marcată. În prezența Hp, enzima descompune ureea, în urma căreia aerul expirat conține CO2 marcat cu un izotop de carbon (13C sau 14C), al cărui nivel este determinat prin spectroscopie de masă sau respectiv folosind un contor de scintilație.
Tabelul 3.1 Comparația valorii de diagnostic a testelor pentru detectarea Hp
Metoda Avantaje Dezavantaje Aplicație
Cultură Biopsie Acuratețea identificării Sensibilitatea la antibiotice poate fi determinată in vitro Nevoia de teste repetate Cost ridicat Nevoia de medii speciale care necesită mult timp pentru a obține rezultatul Antibiotice ultima generație sau PPI poate duce la rezultate fals negative Diagnostic Observare dispensar după terapia de eradicare
Disponibilitatea biopsiei histologice "Standard de aur" Nevoia de teste repetate Cost ridicat Nevoia de medii speciale care necesită mult timp pentru a obține un rezultat Administrarea de antibiotice de ultimă generație sau PPI poate duce la rezultate fals negative Diagnostic Evaluarea stării gastrice mucoasa Urmărirea dispensarului după terapia de eradicare
PPI - inhibitori ai pompei de protoni
Regimuri utilizate pentru eradicarea HP
STANDARDE DE AUR
„Etalonul aur” în eradicarea Hp a fost considerat anterior o combinație de subcitrat de bismut coloidal (de exemplu, De-Nol), prescris timp de 4 săptămâni, cu medicamente antibacteriene(amoxicilină și metronidazol sau tetraciclină) administrate în primele două săptămâni de tratament. Această schemă a demonstrat o eficiență ridicată în ceea ce privește eliminarea Hp, dar nu poate fi considerată ideală datorită frecvenței ridicate de dezvoltare efecte secundareși un regim complex de medicamente, care poate duce la refuzul pacientului de la tratament.
DIAGRAMA CU DOUĂ COMPONENTE
Când căutați regimuri de tratament optime ( Eficiență ridicată cu o incidență scăzută a efectelor secundare și ușurința administrării), au fost studiate schemele cu două componente. Rezultatele obținute cu combinația de omeprazol cu amoxicilină au fost foarte controversate. Ratele de eradicare a HP au variat de la 0 la 92% (medie 60%). Cu toate acestea, printre experți, opinia a crescut că omeprazolul în combinație cu amoxicilină nu dă frecventa inalta eradicarea bacteriilor.
Alte regimuri bidirecționale sunt combinația dintre PILORID și claritromicină și combinația omeprazol cu claritromicină.
· Combinația dintre PILORID și claritromicină a demonstrat eficacitate în 82 - 96% din cazuri, ceea ce este comparabil cu eficacitatea regimurilor cu trei componente.
· Combinația de omeprazol cu claritromicină a demonstrat o eficacitate semnificativ mai mică (66% în medie).
DIAGRAMA TREI PIESE
Recent, există o tendință în Europa de a utiliza cursuri mai scurte de tratament care vizează eradicarea HP. Studiul MATCH-1 a comparat cinci regimuri diferite de combinare a omeprazolului cu două antibiotice, demonstrând eficacitatea de la 79% la 96%. Aceste regimuri de tratament au fost înregistrate în unele țări europene și în alte părți ale lumii.
Revizuire de literatura
Următoarele sunt regimurile cele mai utilizate pentru eliminarea Hp. Trebuie remarcat faptul că, pe lângă diferențele dintre doze și durata tratamentului, studiile au diferențe de populație, diferite tehnici de diagnostic(tipurile și numărul de teste efectuate), precum și diferitele metode de analiză utilizate pentru calcularea nivelului de eliminare.
Monoterapie
Claritromicină 1000 - 2000 14 11 - 54 34
SWR * 480 - 720 14 -28 19 -33 25
Amoxicilină 50 -1500 14 - 28 0 - 28 13
CER ** 900 - 2100 21 - 42 0 - 56 10
Omeprazol 20 - 40 14 - 28 0 - 17 4
Lansoprazol 30 - 60 14 - 56 0 - 10 3
Ranitidină 300 28 - 56 0 - 4 1
* KSV - subcitrat de bismut coloidal; ** SSB- subsalicilat de bismut
Circuit bicomponent
Medicament Doza zilnică (mg) Durata (zile) Rata de eradicare (%) Date generalizate (%)
Omeprazol + Claritromicină 20 -40 1000 -1500 14 - 28 14 27 - 88 66
Ranitidină + Claritromicină 300 - 1200 1000 - 2000 12 - 14 12 - 14 50 - 84 70
Metronidazol + Amoxicilină 1000 - 2000 50 0 - 2000 5 - 30 7 - 30 56 - 80 68
SWR + metronidazol 480 600 - 1500 7 - 56 38 - 9168
Omeprazol + amoxicilină 20 - 40 1500 - 2000 14 - 28 14 0 - 92 60
Ranitidină + amoxicilină 300 - 1200 2000 10 - 14 10 -14 32 - 65 57
Schema cu trei componente
Medicament Doza zilnică (mg) Durata (zile) Rata de eradicare (%) Date generalizate (%)
Omeprazol + Claritromicină + Metronidazol 40 1000-1200 500 -1000 14 - 28 7 - 14 7 - 14 86 - 92 89
SWR * + metronidazol + tetraciclină 480 600 - 1200 14 -28 7 - 14 7 - 14 40 -94 86
Omeprazol + metronidazol + Amoxicilină 20 - 40 800 - 1500 1500 - 3000 14 - 28 7 - 15 7 - 15 43 - 95 77
Ranitidină + metronidazol + Amoxicilină 300 - 1200 100 - 1500 1500 - 2250 21 - 42 12 - 14 12 - 14 44 - 88 78
SWR + metronidazol + Amoxicilină 480 750 - 2000 1500 - 2250 14 - 28 7 - 14 7 - 15 43 - 95 77
SWR + tinidazol + amoxicilină 480 1000 1000 - 3000 10 - 28 7 - 13 7 - 13 59 - 83 70
O schemă în trei părți de o săptămână
omeprazol + amoxicilină + claritromicină 20 - 40 1500 - 2000 500 - 1000 7 76 - 100 89
Omeprazol + metronidazol + claritromicină 20 - 40 800 500 - 1000 7 79 - 96 89
SWR + metronidazol + tetraciclină 480 1200 - 1600 1000 - 2000 7 71 - 94 86
Omeprazol + metronidazol + amoxicilină 40 800 - 1200 1500 - 2000 7 78 - 91 83
CWS + Omeprazol + claritromicină 480 20 - 40 500 - 1500 7 40 - 92 77
Omeprazol + Tinidazol + Claritromicină 20 - 40 1000 500 - 1000 7 50 - 95 76
Care este eficacitatea combinației Pylorid + claritromicină?
Doza zilnică de medicament (mg) durata (zile) Rata de eradicare (%) Date generalizate (%)
PILORID + claritromicină 800 1000 - 1500 14 - 28 14 82 - 96 90
Care este eficacitatea combinației Pylorid cu alte antibiotice?
Doza zilnică de medicament (mg) durata (zile) Rata de eradicare (%)
Pilorid + claritromicină + amoxicilină 800 1000 -1500 1500 - 2000 7 - 14 96
Pilorură + tetraciclină + metronidazol 800 1000 1000 - 1200 7 - 14 88
Pilorid + claritromicină + metronidazol 800 500 1000 7 86
INFLUENȚA PE PROCESUL PLANTEI
Având în vedere că majoritatea publicațiilor sunt dedicate Hp, trebuie reamintit că terapia de eradicare ar trebui să vizeze nu numai distrugerea agentului patogen, ci și vindecarea ulcerului și ameliorarea simptomelor asociate acestuia. De aceea, se recomandă continuarea terapiei antisecretorii timp de 4 săptămâni pentru ulcerul duodenal și timp de 8 săptămâni pentru ulcerul gastric.
Terapia ideală de eradicare poate fi considerată o terapie care îndeplinește următoarele cerințe:
Nivel constant ridicat de eradicare a HP
Mod de recepție simplu (comoditate)
· Frecventa joasa efecte secundare
Economie
· Influența minimă a tulpinilor rezistente asupra frecvenței eradicării · Efect efect asupra procesului ulcerativ.
Se crede că terapia de eradicare va schimba cursurile scurte sau lungi de medicamente antisecretorii din poziția terapiei preferate la majoritatea pacienților cu ulcer peptic. Medicii câștigă experiență în utilizarea terapiei de eradicare; tot mai des, tratamentul este prescris empiric (fără confirmarea de laborator a diagnosticului). Nevoia de medicamente care nu numai că au o activitate ridicată în raport cu Hp, dar sunt, de asemenea, convenabile de luat, ameliorează rapid simptomele, deși au efecte secundare minore, crește rapid.
Nu există nicio îndoială că PILORID își va lua locul cuvenit în tratamentul bolilor gastro-intestinale asociate cu infecția cu Hp.
Adesea, patologiile gastro-intestinale sunt provocate de infecția cu Helicobacter pylori. Boala este însoțită de greață, durere în regiunea epigastrică, arsuri la stomac și complicații periculoase sub formă de ulcer peptic, gastrită și neoplasme maligne. La primele simptome ale helicobacteriozei, se recomandă consultarea unui medic care va prescrie tratament, dietă și recomandări profilactice.
Cum și de ce apare patologia?
Helicobacter pylori este activat numai într-un organism slăbit cu imunitate redusă.
Infecția cu Helicobacter pylori se dezvoltă ca urmare a intrării bacteriilor Helicobacter pylori în tractul gastro-intestinal (GIT). Pătrunzând în corp, microbul este introdus în straturile mucoase ale stomacului și se dezvoltă. Pentru a supraviețui în mediul acid al organului, microorganismul este acoperit cu un film protector și secretă o enzimă - urează, care neutralizează acidul clorhidric. În procesul activității vitale, produce toxine, datorită cărora membranele mucoase ale stomacului și ale duodenului sunt iritate și apare inflamația. Modalitățile de infecție, ca cauze, sunt următoarele:
- nerespectarea igienei personale;
- contactul cu saliva unei persoane bolnave;
- utilizarea ustensilelor și obiectelor care nu au fost igienizate;
- aglomerarea de oameni, printre care există o persoană bolnavă;
- utilizarea apei și a alimentelor contaminate cu Helicobacter.
O cauză indirectă a bolii cu infecție cu H. pylori poate fi fumatul și consumul de alcool. Otravurile conținute în alcool și nicotină slăbesc proprietățile protectoare ale membranei mucoase ale tractului gastrointestinal, perturbă secreția secrețiilor, ceea ce facilitează activitatea vitală a microorganismului și promovează reproducerea acestuia.
Simptome: cum se manifestă boala?
 Toxinele provoacă greață și vărsături.
Toxinele provoacă greață și vărsături. Boala nu este întotdeauna acută și nu se face simțită mult timp. Sub influența factorilor nefavorabili, bacteria este activată și apar următoarele semne de infecție cu Helicobacter pylori:
- greață sau vărsături;
- durere și senzație de arsură în regiunea epigastrică;
- arsuri la stomac;
- o senzație de greutate în stomac, chiar și după ce ați mâncat o cantitate moderată de alimente;
- gazare excesivă;
- scaun supărat;
- gust acru sau amar în gură;
- deteriorarea generală a stării.
Care sunt complicațiile?
Infecția cu helicobacterie poate duce la consecințe sub forma următoarelor boli:
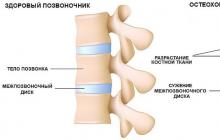
- Gastrită. Sub influența toxinelor microbului, membranele stomacului sunt iritate, ceea ce provoacă un proces inflamator. Această afecțiune poate duce la anemie, secreție afectată și disfuncție a organelor mucoase.
- Boala ulcerului peptic. Se caracterizează printr-o scădere a producției de mucus protector și nivelul prostaglandinelor, precum și suprimarea formării de noi celule ale epiteliului stomacului din cauza toxinelor Helicobacterium. Un ulcer de stomac este periculos din cauza perforației, sângerărilor interne și a morții.
- Duodenita. Apare datorită localizării bacteriilor în duoden și provoacă o perforare prin pereții organului, pancreatită, tulburări ale ficatului și tractul biliar, sângerare.
- Adenocarcinom. Formarea malignă apare datorită eliberării de toxine de către Helicobacter, care sunt similare în compoziție cu agenții cancerigeni. Din acest motiv, apare gastrita atrofică, în care celulele stomacului renasc în cele canceroase.
Cum se efectuează diagnosticul?
 Impuritățile negre din scaun indică sângerări.
Impuritățile negre din scaun indică sângerări. Măsuri de diagnostic condus de un gastroenterolog. Medicul află natura durerii, este interesat de dieta pacientului, palpează și sondează regiunea epigastrică. O infecție provocată de bacteria Helicobacter are semne similare ale altor boli gastro-intestinale. Prin urmare, medicul prescrie examinări astfel încât pacientul să le supună, inclusiv următoarele proceduri de diagnostic:
- analiza fecalelor pentru sângele ocult;
- test de sânge - general și pentru a determina prezența bacteriilor Helicobacter;
- testul ureazei;
- endoscopie;
- reacție în lanț a polimerazei pentru detectarea anticorpilor unui microorganism;
- radiografia de contrast a tractului digestiv;
- iar duodenul;
- Scanare CT.
Tratament: ce metode sunt eficiente?
Terapia medicamentoasă
Regimul de tratament pentru infecția asociată cu HP este realizat de un medic. Automedicația este periculoasă. Bacteria este distrusă prin antibioterapie. Boala Helicobacter pylori este vindecată de următoarele medicamente enumerate în tabel:
| Grupul de droguri | Produs farmaceutic |
| Antibiotice | „Azitromicină” |
| Claritromicina | |
| „Tetraciclină” | |
| "Amoxiclav" | |
| "Amoxicilină" | |
| Analgezice și antispastice | „No-Shpa” |
| "Analgin" | |
| "Papaverină" | |
| "Drotaverin" | |
| Inhibitori ai pompei de protoni | Rabeprazol |
| Omeprazol | |
| Reducerea acidității | „Maalox” |
| „Almagel” | |
| Rennie | |
| Bicarbonat de sodiu | |
| Eliminarea reflexului gag | „Motilium” |
| "Cerucal" |
Dieta
 Corectarea dietei va accelera procesul de vindecare.
Corectarea dietei va accelera procesul de vindecare. În combinație cu administrarea de medicamente, se recomandă. Este strict interzis consumul de alcool, precum și alimente prăjite, grase, murate, bogate în conservanți, condimente fierbinți și condimente. Este recomandat să consumați mese mici de 5-6 ori pe zi. Alimentele trebuie luate în formă de piure sau ras. Ceea ce este permis și interzis pentru infecția cu Helicobacter pylori este prezentat în tabel.
Datorită metodelor de cercetare endoscopică, tratamentul patologiilor organelor sistem digestiv devine mai eficient. Pentru a studia modificările patologice ale membranelor mucoase ale stomacului, precum și ale duodenului, se utilizează tipuri separate de gastroscopie, care sunt necesare nu numai pentru alegerea regimului corect de tratament, ci și pentru luarea materialului pentru biopsie. Procedura se efectuează cu un dispozitiv special numit gastroscop.
Soiuri de cercetare
Toate tipurile de gastroscopie se bazează pe un efect optic special care transferă imagini de pe un dispozitiv localizat de la distanță, care permite medicului să examineze suprafața interioară a organelor. Datorită acestui design al gastroscopului cu sistem de fibră optică și capacității de a refracta fasciculul de lumină, se obține efectul reflexiei totale. Acest lucru vă permite să obțineți o imagine nedistorsionată a interiorului organului examinat.
| Gastroscopie diagnostic | Gastroscopie terapeutică |
|---|---|
| Metoda este utilizată pentru a evalua tipul și ameliorarea membranei mucoase. Cu esofagogastroduodenoscopia (EFGDS), devine posibilă captarea unei zone a membranei mucoase pentru biopsie. Dacă se suspectează gastrită bacteriană, se face testarea HP pentru Helicobacter pylori, principala cauză a gastritei cronice și a ulcerului peptic | În timpul procedurii, se efectuează îndepărtarea planificată a polipilor și formațiunilor benigne, ligarea venelor dilatate ale esofagului, precum și eliminarea ulcerelor non-vindecătoare pe termen lung pe stratul mucos. În cazuri de urgență, un test curativ este utilizat pentru a bloca sângerările ulcerative, a elimina polipii, a administra droguri precum și injecția |
Sfat: Deoarece furtunul gastroscop intră în stomac prin gură pentru testare, un anumit disconfort însoțește procedura. Nu vă fie teamă de inspecție, tubul dispozitivului este subțire și nu interferează cu respirația. Principala condiție este efectuarea procedurii pe stomacul gol, precum și relaxarea cu o rată de respirație calmă.
Caracteristicile tehnicii
Termenul FGDS se numește fibrogastroduodenoscopie. Procedura este metodă eficientă examinări care permit diagnosticarea multor alte tipuri de boli ale tractului gastro-intestinal, inclusiv oncologie. Fibrogastroduodenoscopia este adesea numită fibrogastroscopie, dar metodele nu sunt pe deplin identice.
- Pentru FGDS, cabinetul medicului este dotat cu un complex special cu un monitor și un fibroscop, care permite examinarea suprafeței și a stării mucoasei stomacului. Prezența unei camere mobile deschide posibilitatea examinării duodenului.
- În procesul de fibrogastroscopie, medicul are ocazia să examineze numai interiorul esofagului, suprafața stomacului, pereții acestuia și stratul epitelial. Studiul este prescris dacă este necesar să se obțină o răzuire a celulelor de pe pereții stomacului, acesta este un test pentru prezența bacteriilor Helicobacter.
Important: la fel ca orice manipulare medicală, gastroscopia are o serie de contraindicații, de care medicul ia în considerare atunci când prescrie procedura. Manipularea nu provoacă consecințe speciale, cu excepția senzațiilor neplăcute din gât.
Metode de diagnostic combinate
Testul Helicobacter pylori
Infecția cu acest microb este adesea numită cauza bolii ulcerului peptic. Prezența Helicobacter pylori provoacă, de asemenea, gastrită și cancer de stomac. Locul de reproducere bacterian este mediul acid al stomacului. Datorită tehnicii gastroscopiei, a devenit posibil să se efectueze teste HP cu o privire de ansamblu asupra tractului gastro-intestinal pentru a selecta un loc adecvat pentru biopsie.
O metodă unică vă permite să detectați activitatea ureazei unui microb care emite dioxid de carbon în timpul descompunerii ureei. Se prelevează o probă de biopsie în timpul gastroscopiei. După culoarea materialului selectat, plasat într-un mediu special, se evaluează numărul de bacterii care îl locuiesc. Un test rapid poate da următoarele rezultate:
- trei plusuri (prima oră de studiu) - semne de infecție semnificativă;
- două plusuri (după 2-3 ore) - un semn de infecție moderată;
- unul plus o zi mai târziu indică o infecție slabă.
Metoda garantează un rezultat rapid, fără costuri suplimentare și pregătirea specială a specialiștilor. dar cantitate minimă bacterii în biopsie și sângerări de stomac reduce precizia rezultatului.
Gastroscopie cu examen OBD
Adesea FGS este combinat cu o examinare a BDS (papila duodenală mare), a cărei localizare este partea descendentă a duodenului. Sarcina principală a acestei mici structuri este de a regla fluxul de bilă și lichid pancreatic, pentru a preveni pătrunderea conținutului intestinal în conducte. Utilizarea dispozitivelor moderne garantează o precizie ridicată a studiului, cu posibilitatea de a vizualiza o imagine mărită pe ecranul monitorului. Examinarea BDS crește timpul de gastroscopie cu câteva minute, manipularea nu este dureroasă, ci foarte neplăcută.

Cromoscopie în endoscopie
Metoda este utilizată pentru a determina în timpul zonelor FGDS cu semne de degenerare a stratului epitelial al membranei mucoase, însoțite de ulcerații și apariția neoplasmelor. Pentru diagnostic, membrana mucoasă este irigată cu coloranți siguri pentru oameni, care colorează anumite zone ale epiteliului cu o culoare contrastantă. Studiul crește eficiența diagnosticării bolilor oncologice ale sistemului digestiv, test de culoare devine un supliment indispensabil rezultatelor biopsiei și histologiei, dar crește durata procedurii.

Sfat: dacă vi s-a prescris fibrogastroduodenoscopie, nu trebuie să neglijați sfaturile privind pregătirea pentru examinare. Recomandările simple ale medicului vor reduce simptomele disconfortului unei proceduri neplăcute, iar rezultatele sale nu vor fi îndoielnice. Sarcina ta este să respiri adânc prin gură, să nu înghiți, să păstrezi o dispoziție pozitivă.