Разпространение и причини за хипертрофия
Географски, разпространението на HCM е променливо. Освен това в различните региони се вземат различни възрастови категории. Трудно е да се предоставят точни епидемиологични данни поради причината, че заболяване като хипертрофична кардиомиопатия няма специфични клинични симптоми. Може да се каже със сигурност, че болестта се открива по -често при мъжете. Третата част от случаите е представена от семейната форма, останалите случаи се отнасят до HCM, която няма връзка с наследствения фактор.
Причината, водеща до хипертрофия на интервентрикуларната преграда (IVS), е генетичен дефект. Този дефект може да възникне в един от десетте гени, всеки от които участва в кодирането на информация относно работата на контрактилния протеин протеин в мускулните влакна на сърцето. Към днешна дата са известни около двеста такива мутации, в резултат на които се развива хипертрофична кардиомиопатия.
2 Патогенеза

Какво се случва с хипертрофия на интервентрикуларната преграда? Има няколко взаимосвързани патологични промени, които настъпват при хипертрофия на миокарда. Първо, има удебеляване на миокарда в определената област, разделяща дясната и лявата камера. Удебеляването на интервентрикуларната преграда няма симетрия, така че такива промени могат да възникнат навсякъде. Най -неблагоприятният вариант е удебеляване на преградата в изходящия тракт на лявата камера.
Това води до факта, че една от листовките на митралната клапа, която разделя лявото предсърдие и вентрикула, започва да контактува с удебелената IVS. В резултат на това налягането в тази област (еферентна) се увеличава. По време на свиването миокардът на лявата камера трябва да работи с по -голяма сила, така че кръвта от тази камера да потече в аортата. При условия на продължително повишено налягане в изходящия участък и при наличие на IVS хипертрофия на сърцето, миокардът на лявата камера губи предишната си еластичност и става твърд или твърд.
Загубвайки способността да се отпуска адекватно по време на диастола или пълнене, лявата камера започва да изпълнява по -зле диастоличната си функция. Веригата от патологични промени не свършва дотук, диастоличната дисфункция води до влошаване на кръвоснабдяването на миокарда. Има исхемия (кислородно гладуване) на миокарда, която впоследствие се допълва от намаляване на систоличната функция на миокарда. В допълнение към IVS, дебелината на стената на лявата камера може също да се увеличи.
3 Класификация

Понастоящем се използва класификация, която се основава на ехокардиографски критерии, които позволяват да се разграничи хипертрофичната кардиомиопатия в следните опции:
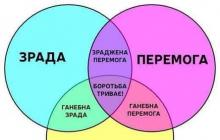
- Обструктивна форма. Критерият за този вариант на хипертрофична кардиомиопатия е разликата в налягането (градиент на налягане), която възниква в областта на изходящия тракт на лявата камера и варира от 30 mm Hg. и по -високо. Този градиент на налягане се генерира в покой.
- Латентна форма. В покой градиентът на налягането е под 30 mm Hg. При извършване на стрес тест той се увеличава и е повече от 30 mm Hg.
- Необструктивна форма. Градиентът на налягането в покой и по време на стрес теста не достига 30 mm Hg.
4 симптома

Не винаги наличието на хипертрофия на интервентрикуларната преграда и лявата камера има някои клинични признаци. Пациентите могат да живеят много и едва след седемдесетгодишния етап започват да проявяват първите признаци. Но това твърдение не се отнася за всички. В края на краищата има форми на хипертрофия на IVS, които се проявяват само при условия на интензивна физическа активност. Има опции, които се чувстват с минимална физическа активност. И всичко по -горе е свързано с частта, в която междувентрикуларната преграда е удебелена. В друг случай внезапната сърдечна смърт може да се превърне в единствената проява на болестта.
На първо място, симптомите ще се появят с обструктивна форма на хипертрофия. Най -честите оплаквания на пациенти с хипертрофия на IVS в изходящия тракт ще бъдат следните:
- диспнея,
- болка в гърдите
- замаяност,
- припадъци
- слабост.
Всички тези симптоми са склонни да прогресират. По правило те се появяват за първи път по време на физическа активност. С напредването на болестта симптомите също се усещат в покой.
5 Диагностика и лечение

Въпреки факта, че стандартната диагностика трябва да започне с оплакванията на пациентите, за първи път IVS и хипертрофия на лявата камера могат да бъдат открити с помощта на ехокардиографско изследване (ехокардиография, ултразвук на сърцето). В допълнение към физическите методи за диагностициране на МСВ и хипертрофия на лявата камера, извършвани в лекарския кабинет, се използват лабораторни и инструментални методи. От инструментални методидиагностиката прилага следното:
- Електрокардиография (ЕКГ). Основните ЕКГ признаци на миокардна хипертрофия на интервентрикуларната преграда и лявата камера са: признаци на претоварване и уголемяване на лявото сърце, отрицателни Т вълни в гръдните канали, дълбоки атипични Q вълни в отводи II, III aVF; нарушение на ритъма и проводимостта на сърцето.
- Рентгенография на гръдния кош.
- Ежедневно холтерово ЕКГ наблюдение.
- Ултразвук на сърцето. Днес този метод е водещ в диагностиката и представлява "златния стандарт".
- Ядрено -магнитен резонанс коронарография.
- Генетичната диагностика използва метод на картографиране. Използва се ДНК анализ на мутантни гени.
Всички тези диагностични методи се използват не само за диагностициране на HCM, но и за провеждане диференциална диагнозаза редица подобни заболявания.

Лечението на хипертрофична кардиомиопатия има няколко цели: да намали проявите на заболяването, да забави прогресията на сърдечната недостатъчност, да предотврати животозастрашаващи усложнения и пр. Както повечето, ако не всички сърдечни заболявания HCM изисква немедикаментозни мерки, които допринасят за прогресията на заболяването. Най -важните са нормализиране на телесното тегло, отхвърляне на лошите навици, нормализиране на физическата активност.
Основните групи лекарства за лечение на МСВ и хипертрофия на лявата камера са бета-блокери, блокери на калциевите канали (верапамил), антикоагуланти, ангиотензин-конвертиращи ензимни инхибитори, ангиотензин рецепторни антагонисти, диуретици, антиаритмици клас 1А (дизодарамид). За съжаление, HCMP е трудно да се отговори медикаментозно лечение, особено ако има обструктивна форма и недостатъчен ефект от лекарствената терапия.
Днес има следните възможности за хирургична корекция на хипертрофия:
- изрязване на хипертрофирания сърдечен мускул в областта на IVS (миосептектомия),
- подмяна на митралната клапа, ремонт на митралната клапа,
- отстраняване на хипертрофирани папиларни мускули,
- алкохолна аблация на преградата.
6 Усложнения

Въпреки факта, че такова заболяване, хипертрофична кардиомиопатия, може да бъде напълно асимптоматично, то може да има следните усложнения:
- Ненормален сърдечен ритъм. Могат да възникнат нефатални (нефатални) ритъмни нарушения, като синусова тахикардия. В други ситуации HCM може да се усложни от по -опасни видове аритмии - предсърдно мъждене или камерно мъждене. Това са последните два варианта на аритмии, които възникват при хипертрофия на IVS.
- Нарушение на проводимостта на сърцето (блокада). Около една трета от случаите на HCM могат да бъдат усложнени от запушвания.
- Внезапна сърдечна смърт.
- Инфекциозен ендокардит.
- Тромбоемболични усложнения. Образуваните кръвни съсиреци на определено място от съдовото легло могат да се разпространят с кръвния поток и да запушат лумена на съда. Опасността от такова усложнение е, че тези микротромби могат да проникнат в съдовете на мозъка и да доведат до нарушаване на мозъчното кръвообращение.
- Хронична сърдечна недостатъчност. Прогресирането на заболяването постоянно води до факта, че първо диастоличната, а след това и систоличната функция на лявата камера намалява с развитието на признаци на сърдечна недостатъчност.
Хипертрофичната кардиомиопатия (HCM) е изолирана лезия (деформация) на сърдечния мускул, по -специално удебеляване на камерната стена (обикновено лявата). В същото време обемът на кухината му остава нормален (по -рядко намалява), но диастоличната функция, тоест притока на кръв към сърцето, се влошава значително. Защо възниква аритмия. Заболяването е първично.
Хипертрофичната кардиомиопатия причинява увреждане на сърцето
HCM е наследствено сърдечно -съдово заболяване. Среща се в 1 случай от 500, по-често сред населението в трудоспособна възраст. Възможни са обаче спонтанни мутации в напреднала възраст (некласическа болест на Фабри) и ранна проява при деца.
Причини за патология
Развитието на заболяването е свързано с анормално подреждане на мускулните влакна, което се причинява от генни мутации (промени в клетките, отговорни за контрактилните протеини). Това е автозомно доминантна патология, често асиметрична проява. В 60% от случаите има хипертрофия на интервентрикуларната преграда (IVS), по -рядко - върха на органа, понякога - средните сегменти.
В днешно време клинична медицинаса идентифицирани повече от 400 възможни мутации - причини сред гените:
- β-миозин, протеин С, леки и тежки вериги β;

Хипертрофията на интервентрикуларната преграда е доста често срещана патология
- тропонин Т, С, I;
- калиеви канали;
- а-актин;
- протеин киназа тип А;
- титин.
В първите две групи най -често се появяват деформации. Генът на тропонин Т е отговорен за момента на настъпване на проявите на заболяването (възрастта на човека), клиничните признаци на протичането и продължителността на живота. Патологията няма предпочитания за възраст и пол, дълго време може да не се усеща.
Гените на здравите родители могат да мутират по време на бременност или в по -късния живот на детето под въздействието на негативни фактори: радиация, йонизация, инфекции, лоши навици (тютюнопушене, алкохол, употребата на други повърхностно активни вещества).

Пушенето и алкохолизмът на бременни жени могат да провокират генна мутация при дете
Класификация на заболяването
Хипертрофичните кардиомиопатии се класифицират по няколко критерия. Всички те са отразени в таблицата.
| Тип | Описание (индикатори) |
|---|---|
| Хемодинамика | |
| Без препятствия | Систоличният градиент е нормален |
| Обструктивна (субаортална стеноза) | Настоящ (надстроен) |
| По вид обструкция (градиент на систоличното налягане) | |
| Базал | ≥30 mmHg Изкуство. |
| Лабилни | Рязки и големи колебания |
| Латентен | |
| По етапи на запушване | |
| Аз | |
| II | |
| III | |
| IV | > 25 mm Hg Изкуство. |
| По местоположение | |
| Лява камера (LV) | Асиметрични (базална IVS, цяла IVS, цяла IVS и свободна LV стена, връх с включване на преградата и LV) и симетрични (цяла камерна кухина). |
| Дясна камера (RV) | Същите промени в дясната камера (умерени, средни, резки). |
| По етапи на протичане на заболяването | |
| Компенсаторно | Лека клапна недостатъчност (20-25%), предсърдна хипертрофия и дилатация. |
| Подкомпенсаторно | Значителна недостатъчност (25-50%), задръстване на кръвта, бивентрикуларно претоварване, белодробна хипертония |
| Декомпенсаторно | Рязка обструкция (връщане на кръв - 50-90%), обща сърдечна недостатъчност. |
Хипертрофичната обструктивна кардиомиопатия засяга аортата, кухината и стените на органа, митралната клапа. Неизправностите на тези елементи се отразяват в редица признаци.

Кардиомиопатията може да засегне различни области и области на сърцето
Типични симптоми
Към общите клинични признацивключват:
- Прояви на сърдечна недостатъчност (90% от случаите): задух, повишена умора, нощни пристъпи на задушаване. гръдна болка (притискаща, свиваща), която не изчезва с болкоуспокояващи. Провокирано от повишаване на систоличното налягане.
- Очевидни, осезаеми неуспехи в работата на сърцето (чести и прекомерни или обратно редки контракции, прекъсвания. 70% от случаите).
- Замаяност, припадък и замаяност (синдром на ниски емисии. Честота 20-25%).
- Исхемия, причинена от кислороден глад поради съдова деформация, нарушено кръвообращение, постоянно напрежение в мускулите, стените на капилярите и вентрикулите.
- В 30% от случаите внезапната смърт (загуба на съзнание за повече от час) е единственият признак на продължаващо заболяване.

При тази патология често се наблюдават замаяност и припадък.
Симптомите могат да се увеличат с физическо натоварване, стрес (моментът на движение на червата), рязка промяна в позицията до вертикална (наклон). Хипертрофичната кардиомиопатия има редица рискове и усложнения.
Възможни усложнения
Най-лошата възможна прогноза е внезапна сърдечна смърт (1-6% годишно, 60% от които са в покой). При 5-10%се отбелязва развитието на систолична дисфункция на вентрикула. Усложненията включват също инфекциозен ендокардит и тромбоемболия, инфаркт и инсулт.
Хипертрофията на IVS и запушването на вентрикуларния изходящ тракт (35-50% от случаите) са опасни от появата на животозастрашаващи аритмии и артериална хипотония... Поради увеличената преграда клапанът се издига на повърхността и в момента на свиване на вентрикулите се привлича от кръвния поток, който пречи на нормалната циркулация на последните.

Това заболяване може да причини симптоми на хипотония, когато налягането падне до критично ниско ниво.
Работниците и професионалните спортисти са най -податливи на SCD (внезапна сърдечна смърт). Рисковата група включва хора, страдащи от затлъстяване и други заболявания, като исхемия.
Диагностика на заболяването
HCM по време на диагностичните процедури се характеризира с удебеляване на стената на една или двете вентрикули от 1,5 cm или повече, нарушение на диастолата. Освен това има замяна на мускулна тъкан с фиброзна тъкан, аномалии в съдовете и целия миокард. Диагностиката и лечението на хипертрофична кардиомиопатия се извършва на няколко етапа.
Първоначален преглед (наличен у дома):
- Проучване на анамнезата: естеството на хода на заболяването, първата проява, която е свързана с увеличаване на симптомите, дали някой подобен страда в семейството, дали са регистрирани смъртни случаи.
- Визуална проверка на кожата за болезнена белота или цианоза.

Лекарят на рецепцията задължително трябва да изслуша пациента за наличие на систоличен сърдечен шум
- Сърдечен ритъм (определяне на промяната в големината), аускултация (определяне на систолични шумове), измерване на налягане.
Вторичен преглед (в болница):
- Общ и химичен анализ на кръв, урина, изпражнения, коагулограма (изследване на съсирването и кръвни съсиреци). Те ви позволяват да определите наличието на съседни възпаления и общото състояние на тялото.
- Ехокардиография (EchoCG). Открива шумове, при HCM има систолични шумове над аортата. Определя сърдечните дефекти, размера на кухините и дебелината на стените (има намаляване на кухината на вентрикула в комбинация с уплътняване на IVS и стената). Ако методът не може да се приложи (например пациентът е със затлъстяване), се извършва радионуклидна вентрикулография (инжектиране на контраст в кръвта).
- Електрокардиография (ЕКГ). Показва сърдечната честота, електрическата проводимост и размера на вентрикулите.

За точна диагноза е необходимо да се подложи на ЕКГ
- Ежедневно ЕКГ наблюдение. Помага за проследяване на динамиката на заболяването и ефективността на лечението.
- Тестовете за натоварване са специално организирани лабораторни експерименти на симулатори за идентифициране на характеристиките на хипертрофия и издръжливост на тялото. Те помагат да се направят препоръки за рехабилитация.
- ЯМР (магнитен резонанс). Показва подробно състоянието на всички вътрешни органи.
- Рентгенов. Определя размера на сърцето (с HCM - нормално или леко увеличено) и наличието на задръствания в кръвта. Освен това изключва други възпаления и заболявания.
- Генетичен преглед. Идентифицира мутирал ген, извършва се с участието на роднините на пациента.
Ако след този комплекс диагнозата все още е неточна, тогава се извършва биопсия (събиране на мускулна тъкан) и катетеризация (измерване на налягането отвътре през тръбите).

В някои случаи е необходима сърдечна биопсия
Като се има предвид фактът, че преди внезапна смъртможе да няма други прояви, препоръчително е да се подложите на рутинни прегледи при кардиолог или кардиохирург, терапевт. В 0,5% от случаите въпросната патология се открива в процеса.
Методи за лечение
Лечението на хипертрофична кардиомиопатия е консервативно (медикаментозно) и оперативно. При успешен и стабилен ход на заболяването без признаци на сърдечна недостатъчност: редовно наблюдение, изключване на негативни фактори (недохранване, лоши навици, хипотермия, физическа и емоционална умора). Същите препоръки са общи за всички видове.
Ако съществува риск от SCD (различни аритмии) - хирургична имплантация (електрическо устройство, което следи сърдечния ритъм, което, когато е отслабено, изпраща импулс) С намалена обструкция - двукамерен пейсмейкър, с камерна тахикардия - кардиовертер дефибрилатор. Хирургичното лечение включва миоектомия (отстраняване на част от преградата отвътре), етанолна аблация (въвеждане на алкохолен разтвор в преградата със спринцовка без разрез на гръдната стена, клетките умират, IVS намалява, притока на кръв се възстановява).

Лечението включва използването на цяла гама от лекарства.
С прогресивен и сложен курс - комплекс от лекарства. Като се вземе предвид спецификата на заболяването, тя се извършва в три направления: премахване на симптомите и предотвратяване на развитието на вторични патологии, предотвратяване на SCD, регулиране и поддържане на неврохуморалната система:
- Лекарства, които възстановяват ритъма. За премахване на камерна тахикардия и предсърдно мъждене - Амиодарон или Дизопирамид. Допълнен с инхибитори, диуретици. Ако има повече от един индикатор за риск за SCD, той не се предписва.
- Адренергични блокери (Метопролол, Надолол, Пропранолол). Те се използват за обструктивна или необструктивна форма. Ефективен при 30-60%. Те потискат активността на симпатоадреналната система, което намалява нуждата от кислород на сърдечния мускул. Премахване на симптомите и причиняване на регресия на хипертрофия. Приблизителната доза е 20 mg три пъти дневно, варира в зависимост от динамиката на налягането, честотата на контракциите и проявите на недостатъчност. Предписват се антикоакуланти за предотвратяване на образуването на кръвни съсиреци.

Метопролол помага за намаляване на проявите на хипертония
- Блокери на калциевите канали (верапамил, дизопирамид). Потискайте хипертрофията и облекчавайте симптомите. По отношение на функциите те са подобни на предишната група, ефективността е потвърдена в 60-80% от случаите. Опасно чрез увеличаване на наклона. Методът на приложение е същият. Под наблюдението на лекар дозата се увеличава.
Всяко лечение се извършва строго в медицинско заведение и под постоянно наблюдение.
Това видео ще ви разкаже за характеристиките на хипертрофичната кардиомиопатия и нейните опасности:
Хипертрофия на лявата или дясната част на сърцето възниква поради увреждане на мускулите, клапите на органите, поради нарушение на притока на кръв. Често това се случва с вродени аномалии в развитието, поради повишено кръвно налягане, белодробни заболявания, значителни физически натоварвания. Най -често се установява хипертрофия на лявата камера на сърцето. Това се дължи на по -голямото функционално натоварване в тази област.
Причини за появата
Заболяването възниква поради различни нарушения, които пречат на нормалното функциониране на органа. Миокардът започва да се свива с повишен стрес, метаболизмът в него се увеличава, обемът на тъканите и клетъчната маса се увеличават.
На начална фазасърдечните заболявания поддържат нормалния кръвен поток чрез увеличаване на масата му. Но в бъдеще миокардът се изчерпва и хипертрофията се заменя с атрофия - клетките значително намаляват по размер.
Има два вида патология: концентрична - сърцето се увеличава, стените му се удебеляват, предсърдията / вентрикулите намаляват и ексцентрична (органът е увеличен, но кухините са уголемени).
Сърдечната хипертрофия може да засегне здрави хора, които се занимават с физическа работа и спортисти. На фона на тези промени може да възникне остра сърдечна недостатъчност. Като се занимавате с културизъм, хокей, тежък физически труд, трябва да наблюдавате състоянието на миокарда.
Поради появата на камерна хипертрофия, тя е разделена на 2 вида:
- работещи - поради повишеното натоварване върху здраво тяло;
- заместването е резултат от адаптация към работа с друго заболяване.
Причини за лезия на лявата камера
Най -често мускулът на лявата камера претърпява промени. Ако дебелината му е повече от 1,2 см, това нарушение се случва. В същото време се наблюдава и хипертрофия на IVS (интервентрикуларна преграда) на сърцето. В тежки случаи дебелината може да достигне 3 см, а теглото - 1 кг.
Лошото изпомпване на кръв в аортата се провокира, следователно кръвоснабдяването в цялото тяло се нарушава. Увеличаването на масата води до недостиг на кислород и хранителни вещества. В резултат на това възниква хипоксия и склероза.
Причините за промени в лявата камера: артериална хипертония; кардиомиопатия; стесняване (стеноза) на аортната клапа; повишена физическа активност; хормонални нарушения; затлъстяване; бъбречно заболяване с вторична хипертония.
Причини за левопредсърдно увреждане:
- Артериална хипертония;
- Хипертрофична кардиомиопатия;
- Вродени сърдечни / аортни патологии;
- Общо затлъстяване, особено при деца и юноши;
- Стеноза / недостатъчност на аортната или митралната клапа.
Причини за увреждане на дясната камера
Промените в дясното предсърдие, като правило, са свързани с белодробни патологии и нарушение в малкия кръг на кръвния поток. В дясното предсърдие кръвта тече през кухата вена от тъкани и органи. Оттам той навлиза във вентрикула през трикуспидалната клапа и по -нататък в белодробната артерия и белите дробове.
В последния се осъществява обмен на газ. Именно поради тази причина нарушава нормалната структура на десните участъци поради различни заболявания на дихателната система.
Основните фактори, провокиращи предсърдна хипертрофия на дясностранна локализация:
- Вродени патологии на развитието (ave. Tetrafallot, IVS дефект);
- Хронична обструктивна белодробна болест като емфизем, пневмосклероза, бронхиална астма, бронхит;
- Трикуспидална стеноза / недостатъчност, промени в клапаните белодробна артерия, увеличаване на дясната камера.
Хроничната белодробна патология провокира увреждане на съдовете на малкия кръг, пролиферацията на свързващите тъкани, обмяната на газ и микроциркуларното легло намаляват. В резултат на това кръвното налягане в съдовете на белите дробове се увеличава, така че миокардът започва да се свива с по -голяма сила, което води до хипертрофия.
Стесняването или непълното затваряне на трикуспидалната клапа води до същото нарушение на притока на кръв, както в подобен случай с митрална патология.
Причини за промени в дясната камера: вродени малформации, хронична белодробна хипертония, стесняване на белодробната клапа, повишено венозно налягане при застойна недостатъчност.
Хипертрофия на дясната камера на сърцето възниква, ако дебелината на стената му е повече от 3 мм. Това води до разширяване на отделите и лошо кръвообращение. В резултат на това венозното връщане през кухата вена се нарушава и се появява застой. Пациентите развиват подуване, задух, цианоза на кожата и след това оплаквания от работата на вътрешните органи.
Трябва да се отбележи, че ако лявата камера е повредена, лявото предсърдие също ще пострада. Тогава и правилните отдели също са обект на промени.
Симптоми на хипертрофия на лявата и дясната камера
При увреждане на миокарда на лявата половина се наблюдават: припадък, замаяност, задух, аритмии, болка в тази област, слабост, умора.
При засягане на дясната половина се появяват следните симптоми: кашлица, задух, задух; подуване; цианоза, бледа кожа; нарушение на ритъма.
Как се диагностицира хипертрофия на двете вентрикули на сърцето?
Най -простите и в същото време ефективни методи са ултразвуково изследване (ултразвук) и ехокардиография (ЕКГ). В процеса се определя дебелината на стените и размерът на органа.
Непреки симптоми на промени, открити на ЕКГ:
- При смяна на десните участъци се променя електропроводимостта, нарушава се ритъмът, наблюдава се отклонението на електрическата ос надясно;
- Отклоненията на оста вляво показват промени в левите участъци, съответно се записват знаци за напрежение.
Възможно е също така да се потвърди или отрече диагнозата въз основа на резултатите от рентгенова снимка на гръдните органи.
Лечение на различни форми на сърдечна хипертрофия
Всички усилия за премахване на болестта са насочени предимно към причината, която я е причинила.
Например, ако възникне разстройство поради респираторно заболяване, курсът на лечение е насочен към компенсиране на белодробната функция. Предписва се противовъзпалителна терапия. Използват се бронходилататорни лекарства и редица други, в зависимост от основната причина.
В случай на увреждане на левите участъци, причинено от артериална хипертония, лечението включва само прием на антихипертензивни лекарства от различни групи, както и диуретици.
Ако се открият тежки дефекти на клапаните, те могат да прибегнат до операция и дори протезиране.
Лечението на хипертрофия на лявата и дясната камера във всички случаи на заболяването включва премахване на симптомите на миокардно увреждане. За това се използва антиаритмична терапия, както и сърдечни гликозиди.
Може би ще предпишат лекарства, които подобряват метаболитния процес в сърдечния мускул (например рибоксин, АТФ и др.). Пациентите се съветват да се придържат към специална диета, да ограничат приема на течности и сол. При затлъстяване усилията са насочени към нормализиране на телесното тегло.
При вродени сърдечни заболявания патологията се елиминира хирургично, ако е възможно. В много тежки случаи, когато структурата е силно нарушена и се развива хипертрофична кардиомиопатия, единственият изход е трансплантацията на органи.
Както може да се прецени от горното, подходът към пациентите се извършва чисто индивидуално. Лекарите вземат предвид всички съществуващи прояви на дисфункция на органите, общото състояние на пациента и наличието на съпътстващи заболявания.
Трябва да се отбележи, че своевременно откритата патология на миокарда може да бъде коригирана в по -голямата част от случаите. След като почувствате първите тревожни симптоми, трябва незабавно да потърсите съвет от специалист - кардиолог. След прегледа той ще установи причината за заболяването и ще предпише адекватно лечение.
Причини
Причините за хипертрофична кардиомиопатия са установени след ултразвуково изследване на близките на пациентите. Оказа се, че 65% от членовете на едно и също семейство имат подобни промени в сърдечния мускул.
Разграничете на етиологична основа 2 форми на заболяването.
Първичен или идиопатичен
Наследствената форма на кардиомиопатия се нарича първична. Развитието на генетиката направи възможно установяването на точния ген, отговорен за развитието на болестта, в половината от случаите. В 50% от семействата не е установена точната индикация за променените гени.
Типът наследяване е автозомно доминантно. Това означава, че болестта задължително се проявява при наследниците, независимо от пола на детето. Хипертрофичната кардиомиопатия при деца се проявява с 50% вероятност, ако единият от родителите е здрав, а другият е носител на мутантния ген. Ако и двамата родители имат генетични промени, тогава вероятността достига 100%.
Учените смятат, че генната мутация може да възникне под влияние на неблагоприятни условия във външната среда (тютюнопушене, предишни инфекции, радиация), които засягат бъдещата майка по време на бременност.
Втори
Вторични промени се образуват след 60 години при пациенти с хипертония, които са имали промени в структурата на мускулната тъкан в пренаталния период.
Установено е, че при 1/5 от пациентите, преживели до напреднала възраст, може да се развие систолна слабост и разширяване на кухината на лявата камера. В такива случаи хипертрофичната кардиомиопатия не се различава от дилатационния тип.
Механизмът на развитие на патологията
В резултат на генетични мутации в мускулната тъкан се появяват "грешни" основни протеинови молекули, които осигуряват процеса на свиване, актин и миозин. Те не произвеждат необходимото количество калории поради рязко намаляване на съдържанието на основни ензими. При 90% от пациентите мускулните клетки губят ориентацията си. В тъканта на миокарда се образуват области, които не са в състояние да се свиват.
В отговор на това други влакна поемат работните функции. Мускулната им маса нараства (хипертрофира), тъй като те трябва да се свиват с повишен стрес. Дебелината на лявата камера се увеличава, въпреки че няма данни за вродени и придобити дефекти и хипертония. В същото време има удебеляване на интервентрикуларната преграда. Това води до стесняване на пътищата за освобождаване на кръв в аортата.
Областите на хипертрофия могат да бъдат разположени във фокуси (по -често на изхода към аортата) или да засегнат по -голямата част от лявата камера. По -рядко те се разпространяват в десните части на сърдечния мускул. Уврежда се клапанните върхове (митрален и аортен), съдовете, които захранват миокарда.
По време на диастолата предсърдията трябва да работят с повишено натоварване, за да запълнят вентрикулите, тъй като тъканите стават плътни, твърди и губят еластичност. Налягането в белодробната циркулация се повишава.
Увеличената мускулна маса изисква повече кислород. Несъответствието между нарастването на миокардните изисквания и възможностите води до развитие на исхемия. Това се улеснява и чрез механично притискане на устието на лявата коронарна артерия.
Видове сърдечни увреждания
Във връзка с равномерността и симетрията на развитието на области на миокардна хипертрофия се разграничават следните форми:
- симетрична (концентрична) - дебелината на стените на лявата камера се увеличава в същата степен по предната, задната повърхност и в областта на преградата, по -рядко се добавя хипертрофия на дясната камера;
- асиметрични - областите на удебеляване се образуват в горната или долната част на интервентрикуларната преграда, тя става един и половина до три пъти по -дебела от задната стена на лявата камера (при нормално сърце те са равни), в 2/3 на пациентите тези промени се комбинират с хипертрофия на областта на предната, страничните стени на лявата камера или върха, без промени в задната стена.
По силата на препятствието за притока на кръв от лявата камера в аортата е обичайно да се разграничават:
- обструктивна хипертрофична кардиомиопатия (субаортална или субклавуларна) - промяната в анатомичните съотношения създава бариера за излизане от кръвта;
- без препятствия - няма бариера.
Клинична картина
Симптомите на хипертрофична кардиомиопатия се появяват за първи път на възраст от 20 до 25 години. Най -типичните са следните:
- Болките зад гръдната кост с притискащ характер, много подобни на пристъпите на стенокардия, имат подобно облъчване на лявото рамо, шията, лопатката. За разлика от ангината пекторис, те не се отстраняват от лекарства, съдържащи нитроглицерин. Има нетипични болки или бодежи.
- Важен знак е увеличаването на недостига на въздух при промяна на хоризонталното положение на тялото във вертикално. С течение на времето засиленият задух води до сърдечна астма и белодробен оток.
- Аритмии, повишена сърдечна честота.
- Замайването, достигащо до припадък, се свързва с недохранване на мозъка. Засилва се с физическо натоварване, напряга се, след обилно хранене, с бързо повдигане от място.
За хипертрофична кардиомиопатия характерна проява е внезапната смърт на човек (класификацията уточнява, че не трябва да минава повече от 1 час от момента на загуба на съзнание, случаят не може да има признаци на насилие).
Как да разпознаем болестта
Диагнозата на заболяването е много трудна. Лекарят трябва да знае фамилната анамнеза (случаи на потвърдено заболяване при роднини или внезапна смърт в ранна възраст), хода на бременността при майката, връзката с индустриални отровни вещества, прехвърлени инфекциозни заболявания, стойте в райони с висока радиация.
По време на прегледа лекарят обръща внимание на бледността на кожата, посиняването на устните, пръстите. Записва се високо или нормално кръвно налягане.
При аускултация се чува характерен шум над проекцията на аортата.
За да се изключи евентуална патология на сърцето и кръвоносните съдове, се проверява общ анализкръв, урина, биохимични тестове за метаболитни продукти, глюкоза, система за коагулация на кръвта.
Допълнителни методи за изследване
Хардуерната диагностика ви позволява точно да идентифицирате проблеми с болестта.
- ЕКГ изследване записва информация за нарушен ритъм, хипертрофия на сърцето, развитие на блокажи.
- Фонокардиограмата записва шумове от определени точки, което дава възможност да се установи връзка между звуковия шум и аортата.
- Рентгеновото изследване показва увеличаване на контурите на сърдечната сянка, но размерът може да е нормален, ако хипертрофията се развие в кухината.
- Ултразвукът е основният метод за поставяне на диагноза. Оценяват се размерите на камерите на сърцето, дебелината на стените, състоянието на клапанния апарат, интервентрикуларната преграда и има нарушение на кръвния поток.
- Магнитно-резонансната томография ви позволява да получите триизмерно изображение на сърцето, да разкриете запушване, степента на дебелина на стената.
- Генетичните изследвания са метод на бъдещето, докато все още са недоразвити.
- С помощта на въвеждането на катетри в сърдечната кухина се изследва и измерва налягането в предсърдията и вентрикулите и скоростта на кръвния поток. Техниката ви позволява да вземете материал за биопсия.
- Коронарографията на сърдечните съдове се извършва при пациенти над 40 години за диференциална диагноза с исхемични лезиисъдове на сърцето.
Биопсия е допустима само ако всички други заболявания са изключени и няма помощ от други диагностични методи. Променените мускулни влакна стават видими под микроскопа.
Лечение
Досега не е постигнато специфично елиминиране на генните мутации. Лечението на хипертрофична кардиомиопатия се извършва с лекарства, които засягат всички аспекти на патогенезата на заболяването.
Когато се открият признаци на заболяване, е необходимо да се ограничи физическа дейност, спрете да спортувате.
Ако пациентът има някакъв хроничен инфекциозни заболявания, се предписват профилактични антибиотици.
Използват се групи лекарства, които блокират адренергичните рецептори, калциевите антагонисти и се добавят лекарства, които намаляват образуването на тромби в кухините на сърцето.
Хирургични методи
Методът на избор за отворено сърце е миотомията - отстраняване на част от интервентрикуларната преграда отвътре или през аортата. Смъртността по време на тези операции достига 5%, което е сравнимо с общата смъртност.
Извършва се по -щадяща техника - чрез пункция на гръдния кош и сърцето, под ултразвуков контрол, в септалната област се инжектира концентриран алкохол. Изкуствено причинена клетъчна смърт, изтъняване на преградата. Намалява се препятствието за преминаване на кръв.
За лечение на нарушения ритъм се имплантира електростимулатор или дефибрилатор (в зависимост от вида на нарушението).
Съвременните данни показват, че процентът на оцеляване след хирургично лечениев рамките на 10 години е 84%, и с постоянен консервативно лечение - 67%.
В случай на запушване се използва операция за подмяна на митралната клапа с изкуствена, това елиминира контакта й с преградата и "изчиства" прохода за притока на кръв.
Ходът на заболяването
Хипертрофия е възможна от момента на раждането. Но при повечето пациенти тя започва да се проявява в юношеска възраст. За три години дебелината на миокардната стена се удвоява. В същото време симптомите на заболяването не се откриват при 70% от пациентите. До 18 -годишна възраст (по -рядко до 40) прогресията на удебеляването на сърдечната стена спира.
В бъдеще се формират клинични прояви с обструктивна патология. В случаите на необструктивни форми, курсът е благоприятен и се открива случайно по време на ЕКГ изследване.
Честотата на годишната внезапна смърт от хипертрофична кардиомиопатия и нейните усложнения сред възрастното население е до 3%, сред децата - от 4 до 6%. Основната причина се счита за вентрикуларна фибрилация.
Какви са възможните усложнения
Хипертрофичната кардиомиопатия не се проявява изолирано, болестта засяга всички аспекти на сърцето, причинявайки сериозни усложнения.
- Аритмии и нарушена проводимост се наблюдават при почти всеки пациент. В зависимост от тежестта, те могат да излязат на първо място по отношение на заплахата за живота на пациента. Директно причиняват спиране на сърцето или предсърдно мъждене.
- Прикрепването на инфекцията на митралната и аортната клапа води до развитие на ендокардит с последваща недостатъчност на клапанния апарат.
- Отделянето на тромб и въвеждането на емболия в съдовете на мозъка (до 40% от случаите), във вътрешните органи, в артериите на крайниците се случва с предсърдно мъждене, пароксизмална форма.
- Развитието на хронична сърдечна недостатъчност е възможно при продължителен ход на заболяването, когато част от мускулните влакна на миокарда се заменя с белезна тъкан.
Прогноза
Лечението може да доведе до временно стабилизиране на хипертрофията. Продължителността на живота не зависи пряко от формата на заболяването. Най -благоприятната прогноза се счита при продължителен асимптоматичен ход, както и при апикална локализация и липса на внезапна смърт сред роднини.
Основният симптом, утежняващ прогнозата при пациенти на възраст от 15 до 50 години, е припадък, откриване на исхемия на ЕКГ и камерна тахикардия. Появата на задух и гръдна болка при пациент драстично увеличава риска от внезапна смърт.
Статистическите проучвания показват от момента на откриване петгодишна преживяемост от 82 до 98%, десетгодишна преживяемост от 64 до 89%, със средногодишна смъртност от 1%.
Трудностите в етиологичните фактори на заболяването правят практически невъзможен всякакъв вид превенция. При тази патология основното внимание трябва да се обърне на идентифицирането, започвайки от юношеството, симптоматична терапия.
Какво е миокардна хипертрофия
Това е автозомно доминиращо заболяване, което издава наследствени признаци на генни мутации, засяга сърцето. Характеризира се с увеличаване на дебелината на стените на вентрикулите. Хипертрофичната кардиомиопатия (HCM) има класификационен код съгласно МКБ 10 # 142. Заболяването е по -често асиметрично, лявата камера на сърцето е по -податлива на увреждане. Това се случва:
- хаотично разположение на мускулните влакна;
- поражение на малките коронарни съдове;
- образуването на области на фиброза;
- възпрепятстване на притока на кръв - пречка за освобождаването на кръв от атриума поради изместването на митралната клапа.
При големи натоварвания на миокарда, причинени от заболявания, спорт или лоши навици, започва защитна реакция на организма. Сърцето трябва да се справи с надутите обеми работа, без да увеличава натоварването на единица маса. Компенсацията започва да се случва:
- повишено производство на протеини;
- хиперплазия - увеличаване на броя на клетките;
- увеличаване на мускулната маса на миокарда;
- удебеляване на стената.
Патологична хипертрофия на миокарда
При продължителна работа на миокарда при натоварвания, които постоянно се увеличават, възниква патологична форма на HCM. Хипертрофираното сърце е принудено да се адаптира към новите условия. Удебеляването на миокарда се случва с бързи темпове. На тази позиция:
- растежът на капилярите и нервите изостава;
- кръвоснабдяването е нарушено;
- влиянието на нервната тъкан върху метаболитните процеси се променя;
- миокардни структури се износват;
- съотношението на размера на миокарда се променя;
- възниква систолична, диастолична дисфункция;
- реполяризацията е нарушена.
Хипертрофия на миокарда при спортисти
Анормално развитие на миокарда - хипертрофия - настъпва неусетно при спортисти. При големи физически натоварвания сърцето изпомпва големи обеми кръв, а мускулите, приспособявайки се към такива условия, се увеличават по размер. Хипертрофията става опасна, провокира инсулт, инфаркт, внезапен сърдечен арест, при липса на оплаквания и симптоми. Не можете рязко да се откажете от обучението, за да не възникнат усложнения.
Спортната хипертрофия на миокарда има 3 вида:
- ексцентричен - мускулите се променят пропорционално - характерно за динамични дейности - плуване, ски, бягане на дълги разстояния;
- концентрична хипертрофия - кухината на вентрикулите остава непроменена, миокардът се увеличава - отбелязва се с игра и статични типове;
- смесени - присъщи на упражнения с едновременно използване на неподвижност и динамика - гребане, колоездене, пързаляне.
Хипертрофия на миокарда при дете
Появата на миокардни патологии от момента на раждането не е изключена. Диагнозата на тази възраст е трудна. Хипертрофичните промени в миокарда често се наблюдават в юношеството, когато кардиомиоцитните клетки активно растат. Удебеляването на предната и задната стена настъпва до 18 -годишна възраст, след което спира. Камерната хипертрофия при дете не се счита за отделно заболяване - това е проява на множество заболявания. Децата с HCM често имат:
- сърдечно заболяване;
- миокардна дистрофия;
- хипертония;
- ангина пекторис.
Причини за кардиомиопатия
Обичайно е да се прави разлика между първични и вторични причини за хипертрофично развитие на миокарда. Първите са повлияни от:
- вирусни инфекции;
- наследственост;
- стрес;
- консумация на алкохол;
- физическо претоварване;
- наднормено тегло;
- токсично отравяне;
- промени в тялото по време на бременност;
- употреба на наркотици;
- липса на микроелементи в организма;
- автоимунни патологии;
- недохранване;
- пушене.
Вторичните причини за хипертрофия на миокарда се провокират от такива фактори:

Хипертрофия на лявата камера
По -често стените близо до лявата камера са податливи на хипертрофия. Една от причините за LVH е високото налягане, което принуждава миокарда да работи в ускорен ритъм. Поради произтичащите от това претоварвания, стената на лявата камера и IVS се увеличават по размер. В тази ситуация:
- губи се еластичността на мускулите на миокарда;
- кръвообращението се забавя;
- нормалното функциониране на сърцето е нарушено;
- има опасност от рязко натоварване върху него.
Кардиомиопатията на лявата камера увеличава нуждата на сърцето от кислород, хранителни вещества... Възможно е да се забележат промени в LVH по време на инструментален преглед. Появява се синдром на малки емисии - замаяност, припадък. Сред признаците, придружаващи хипертрофия:
- ангина пекторис;
- спад на налягането;
- болка в сърцето;
- аритмия;
- слабост;
- високо кръвно налягане;
- чувствам се зле;
- задух в покой;
- главоболие;
- умора;
Хипертрофия на дясното предсърдие
Увеличаването на стената на дясната камера не е заболяване, а патология, която се появява с претоварване в този участък. Възниква в резултат на изтичането на голямо количество венозна кръв от големи съдове. Хипертрофията може да бъде причинена от:
- вродени дефекти;
- дефекти предсърдна преградапри което кръвта влиза едновременно в лявата и дясната камера;
- стеноза;
- затлъстяване.
Хипертрофията на дясната камера е придружена от симптоми:
- хемоптиза;
- виене на свят;
- нощна кашлица;
- припадък;
- болка в гърдите;
- задух без усилие;
- подуване на корема;
- аритмия;
- признаци на сърдечна недостатъчност - подуване на краката, увеличен черен дроб;
- неизправности на вътрешните органи;
- цианоза на кожата;
- тежест в хипохондриума;
- разширени вени в корема.

Хипертрофия на вентрикуларната преграда
Един от признаците за развитието на болестта е IVS (интервентрикуларна преграда) хипертрофия. Основната причина за това разстройство са генните мутации. Септалната хипертрофия провокира:
- вентрикуларна фибрилация;
- предсърдно мъждене;
- проблеми с митралната клапа;
- камерна тахикардия;
- нарушение на изтичането на кръв;
- сърдечна недостатъчност;
- сърдечен арест.
Разширяване на сърдечните камери
Хипертрофията на интервентрикуларната преграда може да провокира увеличаване на вътрешния обем на сърдечните камери. Това разширение се нарича миокардна дилатация. В това положение сърцето не може да изпълнява функцията на помпа, възникват симптоми на аритмия, сърдечна недостатъчност:
- бърза умора;
- слабост;
- диспнея;
- подуване на краката и ръцете;
- ритъмни нарушения;
Сърдечна хипертрофия - симптоми
Опасност от миокардно заболяване при асимптоматично протичане дълго време... Често се диагностицира случайно по време на физически прегледи. С развитието на болестта могат да се наблюдават признаци на миокардна хипертрофия:
- болка в гърдите;
- нарушение на сърдечния ритъм;
- задух в покой;
- припадък;
- умора;
- затруднено дишане;
- слабост;
- виене на свят;
- сънливост;
- подуване

Форми на кардиомиопатия
Трябва да се отбележи, че заболяването се характеризира с три форми на хипертрофия, като се вземе предвид градиентът на систоличното налягане. Всички заедно отговарят на обструктивния тип HCM. Подчертано:
- базална обструкция - състояние на покой или 30 mm Hg;
- латентно - спокойно състояние, по -малко от 30 mm Hg - характеризират се с необструктивна форма на HCM;
- лабилна обструкция - спонтанни интравентрикуларни колебания на градиента.
Хипертрофия на миокарда - класификация
За удобство при работа в медицината е обичайно да се разграничават следните видове миокардна хипертрофия:
- обструктивен - в горната част на преградата, по цялата площ;
- необструктивен - симптомите са леки, диагностицирани случайно;
- симетричен - всички стени на лявата камера са засегнати;
- апикално - мускулите на сърцето се увеличават само отгоре;
- асиметричен - засяга само една стена.
Ексцентрична хипертрофия
При този тип LVH камерната кухина се разширява и в същото време се получава равномерно, пропорционално удебеляване на миокардната мускулатура, причинено от растежа на кардиомиоцитите. При общо увеличение на масата на сърцето относителната дебелина на стената остава непроменена. Ексцентричната миокардна хипертрофия може да засегне:
- междукамерна преграда;
- върха;
- странична стена.
Концентрична хипертрофия
Концентричният тип на заболяването се характеризира със запазване на обема на вътрешната кухина с увеличаване на масата на сърцето поради равномерно увеличаване на дебелината на стените. Има и друго име за това явление - симетрична миокардна хипертрофия. Заболяването възниква в резултат на хиперплазия на миокардиоцитни органели, провокирана високо наляганекръв. Това развитие на събитията е характерно за артериална хипертония.

Хипертрофия на миокарда - степени
За правилната оценка на състоянието на пациента с HCM заболяване е въведена специална класификация, като се отчита удебеляването на миокарда. С колко се увеличава размерът на стените по време на свиването на сърцето, в кардиологията се разграничават 3 степени. В зависимост от дебелината на миокарда, етапите се определят в милиметри:
- умерен - 11-21;
- средно - 21-25;
- изразено - над 25.
Диагностика на хипертрофична кардиомиопатия
В началния етап, с леко развитие на хипертрофия на стената, е много трудно да се идентифицира заболяването. Диагностичният процес започва с интервюиране на пациента, като се установи:
- наличието на патологии при роднини;
- смърт на един от тях в ранна възраст;
- минали заболявания;
- фактът на излагане на радиация;
- външни признаци при визуална проверка;
- стойности на кръвното налягане;
- показатели в кръвта и урината.
Прилага се ново направление - генетична диагностика на хипертрофия на миокарда. Помага за установяване на параметрите на HCMP потенциала на хардуерни и радиологични методи:
- ЕКГ - определя косвени признаци - ритъмни нарушения, хипертрофия на отделите;
- Рентген - показва увеличаване на контура;
- Ултразвук - оценява дебелината на миокарда, нарушен кръвен поток;
- ехокардиография - фиксира мястото на хипертрофия, нарушение на диастоличната дисфункция;
- ЯМР - дава триизмерен образ на сърцето, задава степента на дебелина на миокарда;
- вентрикулография - изследва съкратителните функции.

Как да се лекува кардиомиопатия
Основната цел на лечението е да върне миокарда до оптималния му размер. В комплекса се провеждат дейности, насочени към това. Хипертрофията може да се лекува, когато се диагностицира рано. Важна роля в миокардната лечебна система играе начинът на живот, който предполага:
- спазване на диета;
- отказ от алкохол;
- спиране на тютюнопушенето;
- отслабване;
- изключване на наркотици;
- ограничаване на приема на сол.
Медикаментозното лечение на хипертрофична кардиомиопатия включва използването на лекарства, които:
- намаляване на кръвното налягане - АСЕ инхибитори, антагонисти на ангиотензиновите рецептори;
- регулират нарушенията на сърдечния ритъм - антиаритмици;
- лекарства с отрицателен йонотропен ефект - бета -блокери, калциеви антагонисти от групата на верапамил - отпускат сърцето;
- премахване на течности - диуретици;
- подобряване на мускулната сила - йонотропи;
- под заплаха инфекциозен ендокардит- антибиотична профилактика.
Ефективен метод на лечение, който променя хода на възбуждане и свиване на вентрикулите, е двукамерна пейспинг с съкратено атриовентрикуларно забавяне. По -сложни случаи - изразена асиметрична IVS хипертрофия, латентна обструкция, липса на лекарствен ефект - изискват участието на хирурзи за регресия. За спасяването на живота на пациента се помага от:
- инсталация на дефибрилатор;
- имплантиране на пейсмейкър;
- трансаортна септална миектомия;
- изрязване на част от интервентрикуларната преграда;
- транскатетърна септална алкохолна аблация.

Кардиомиопатия - лечение с народни средства
По препоръка на лекуващия кардиолог можете да допълвате основното ястие с билкови лекарства. Традиционно лечениехипертрофия на лявата камера включва използването на плодове от калина без термична обработка, 100 g на ден. Полезно е да се използват ленени семена, които имат положителен ефект върху сърдечните клетки. Препоръчвам:
- вземете лъжица семена;
- добавете вряща вода - литър;
- задръжте на водна баня за 50 минути;
- Филтрирай;
- пийте на ден - доза от 100 g.
Овесената инфузия има добри отзиви при лечението на HCM за регулиране на работата на сърдечните мускули. Рецептата на лечителите изисква:
- овес - 50 грама;
- вода - 2 чаши;
- загряване до 50 градуса;
- добавете 100 г кефир;
- изсипете сок от репички - половин чаша;
- разбърква се, престоява 2 часа, прецежда се;
- сложете 0,5 с.л. пчелен мед;
- дозировка - 100 g, три пъти дневно преди хранене;
- курс - 2 седмици.
Определение."Миокард" на миокарда на лявата камера (LVHM) - излишък от масата на лявата камера спрямо правилната поради удебеляването (пролиферацията) на миокарда (сърдечния мускул).

Методи за диагностициране на LVH. Понастоящем се използват 3 инструментални техники за диагностициране на LVH:
- Стандартна ЕКГ... Когато се проверява LVH, конвенционалната ЕКГ обикновено се характеризира с ниска чувствителност - не повече от 30%. С други думи, от общия брой пациенти, които обективно имат LVH, ЕКГ позволява да се диагностицира само в една трета. Колкото по -изразена е хипертрофията, толкова по -голяма е вероятността тя да бъде разпозната чрез конвенционална ЕКГ. Тежката хипертрофия почти винаги има ЕКГ маркери. По този начин, ако ЕКГ правилно диагностицира LVH, това най -вероятно показва неговата тежка степен. За съжаление, в нашата медицина конвенционалната ЕКГ се придава твърде голямо значение при диагностицирането на LVH. Често, използвайки нискоспецифични ЕКГ критерии за LVHM, лекарите говорят утвърдително за феномена на хипертрофия, където той не съществува в действителност. Не трябва да очаквате повече от стандартен ЕКГ, отколкото може да покаже.
- Ултразвук на сърцето.Това е „златният стандарт“ в диагностиката на LVH, тъй като позволява визуализация в реално време на сърдечните стени и необходимите изчисления. За да се оцени миокардната хипертрофия, е обичайно да се изчисляват относителните стойности, отразяващи масата на миокарда. За простота обаче е допустимо да се знае стойността само на два параметъра: дебелината на предната (интервентрикуларна преграда) и задната стена на лявата камера, което прави възможно диагностицирането на хипертрофия и нейната степен.
- Ядрено -магнитен резонанс (ЯМР)). Скъп метод за сканиране по слой на „зоната на интерес“. За да се оцени LVHM, той се използва само ако ултразвукът на сърцето не е осъществим по някаква причина: например при пациент със затлъстяване и емфизем, сърцето ще бъде затворено от всички страни от белодробна тъкан, което ще направи невъзможно визуализирането ултразвук (изключително рядко, но това се случва).
Дебелината на IVS и LVLV е пряко свързана с хипертрофия на миокарда на лявата камера (клиничното значение на EDR при хипертрофия ще бъде обсъдено от PЅRёR¶Rµ). При превишаване нормална стойностдори един от двата представени параметъра е оправдано да се говори за "хипертрофия".

Причини и патогенеза на LVH. Клинични състояния, които могат да доведат до LVH (в низходящ ред на честотата на възникване):
1. Заболявания, водещи до увеличаване на натоварването на сърцето:
- Артериална хипертония (хипертония, вторична хипертония)
- Сърдечни заболявания (вродени или придобити) - аортна стеноза.
Под натоварването се разбира набор от физически и анатомични параметри на сърдечно -съдовия организъм, които създават пречка за преминаването на кръв през артериите. Зареждането се определя главно от тонуса на периферните артерии. Определена основна стойност на тонуса на артериите е норма и една от задължителните прояви на хомеостазата, която поддържа нивото на кръвното налягане, съобразно текущите нужди на организма. Прекомерното повишаване на артериалния тонус ще отбележи увеличаване на последващото натоварване, което клинично се проявява с повишаване на кръвното налягане. И така, при спазъм на периферните артерии натоварването на лявата камера се увеличава: тя трябва да се свие повече, за да „изтласка“ кръвта през стеснените артерии. Това е една от основните връзки на патогенезата при формирането на "хипертонично" сърце.


Втората често срещана причина, която води до увеличаване на натоварването на лявата камера и следователно създава пречка за артериалния кръвен поток, е аортната стеноза. При аортна стеноза се засяга аортната клапа: тя се свива, калцира, деформира. В резултат на това аортният отвор става толкова малък, че лявата камера трябва да се свие значително повече, за да се гарантира, че адекватният обем кръв преминава през критичното затруднение. Понастоящем основната причина за аортна стеноза е старческото (старческо) увреждане на клапата при възрастните хора.

Микроскопичните промени в хипертрофията на миокарда се състоят в удебеляване на сърдечните влакна, в известна пролиферация на съединителната тъкан. Отначало това е компенсаторно, но при дългосрочно повишено натоварване (например при продължително нелекувана хипертония), хипертрофичните влакна претърпяват дистрофични промени, архитектониката на миокардния синцитий е нарушена и склеротичните процеси в миокарда преобладават. В резултат на това хипертрофията от феномена на компенсация се превръща в механизъм за проява на сърдечна недостатъчност - сърдечният мускул не може да работи с напрежение за неопределено време без последствия.

2. Вродена причина за LVH: хипертрофична кардиомиопатия... Хипертрофичната кардиомиопатия е генетично обусловено заболяване, характеризиращо се с появата на немотивирана LVH. Проявлението на хипертрофия се случва след раждането: като правило, в детска или юношеска възраст, по-рядко при възрастни, но във всеки случай не по-късно от 35-40 години. По този начин, при хипертрофична кардиомиопатия, LVH възниква на фона на пълно благосъстояние. Това заболяване не е рядкост: според статистиката 1 човек на 500 страда от него. клинична практикаВиждам 2-3 пациенти с хипертрофична кардиомиопатия всяка година.
За разлика от хипертоничното сърце, при хипертрофична кардиомиопатия LVH може да бъде много изразена (тежка) и често асиметрична (повече за този PЅRёR¶Pµ). Само при хипертрофична кардиомиопатия дебелината на стената на лявата камера понякога достига "трансцендентални" стойности от 2,5-3 см или повече. Микроскопски архитектониката на сърдечните влакна е силно нарушена.

3. LVH като проява на системни патологични процеси.
- Затлъстяване.Наднорменото тегло не е чисто козметичен проблем. Това е дълбок патофизиологичен процес, засягащ всички органи и системи, при който се променят биохимичните процеси, психодинамиката на мисленето, човешкото аз и т. Н. При затлъстяването мастната тъкан се отлага в излишък не само под кожата, но и в почти всички органи . Сърцето е принудено да доставя кръв на „тялото с цялата му излишна маса“. Такова повишено натоварване не може да не повлияе на сърдечната функционалност - със сигурност се увеличава: сърцето се свива по -често и по -силно. По този начин, при затлъстяване, LVHM може да се развие при липса на персистираща артериална хипертония.
При затлъстяване миокардът се удебелява не само поради пролиферацията на сърдечните влакна и съединителната тъкан, но и поради отлагането на излишната мазнина.
- Амилоидоза(първичен или вторичен) - патология, при която по време на вътрешни органисе отлага специален протеинов амилоид, което води до развитие на дифузна склероза и органна недостатъчност. При цялата възможност за развитие на LVH в резултат на амилоидоза, това рядко излиза на преден план в клиниката на заболяването: други органи (например бъбреците) са по -засегнати по -значително, което ще определи специфичната картина на заболяването.
4. Относително естествени причини за LVH.
- Възрастна възраст ... Сенилната възраст се характеризира с бавно, но постоянно прогресиращо разграждане (дистрофия) на всички органи и системи. Специфичното тегло на водата и паренхимните компоненти в органите намалява; напротив, склеротичните процеси се засилват. Сърцето на старец не прави изключение: мускулните влакна стават по -тънки, разхлабват се, в същото време съединителната тъкан се развива мощно, поради което основно LVHM се появява в напреднала възраст. Това, което е важно да се знае, старческата LVH, при липса на други причини, никога не достига значителни стойности. Той не надвишава степента на „незначителен“ и по-често е само възрастово явление, без особена клинична значимост.
- Сърцето на спортиста. то еза лица, които се занимават с професионален спорт от дълго време. LVH при такива субекти може да се нарече в чист вид компенсаторна (работеща), както и съпътстваща хипертрофия на скелетните мускули. След края на спортната кариера, LVH претърпява пълна или частична регресия.
Следните заболявания (състояния) водят до концентрична LVH:
S-хипертрофията няма особено клинично значение, тъй като по-често е маркер на "застаряващото" сърце. Понякога този тип хипертрофия се среща при хора на средна възраст.
Клинично значение на LVH. Заболяванията, водещи до развитие на LVH, могат да бъдат асимптоматични за дълго време (години, десетилетия) или да имат неспецифични прояви: например главоболие с артериална хипертония. Повечето ранен симптом LVH (който между другото може да се появи след години на хипертрофия) е диспнеяс обичайната физическа активност: ходене, изкачване на стълби. Механизъм за задух: Р´РёР ° стоР»РёС ‡ ескР° СЏ СЃРµСЂРґРµС ‡ РЅР ° СЏ РЅРµR´RSSЃС‚R ° С‚РѕС ‡ РЅРѕСЃС‚С... Известно е, че кръвонапълването на сърцето настъпва по време на периода на диастола (релаксация): кръвта се движи по градиента на концентрацията от предсърдията към вентрикулите. При хипертрофия лявата камера става по -дебела, по -твърда, по -плътна - това води до факта, че процесът на отпускане, разтягане на сърцето става труден, става дефектен; съответно кръвоснабдяването на такава камера е нарушено (намалено). Клинично това явление се проявява с недостиг на въздух. Симптомите на диастолична сърдечна недостатъчност под формата на задух и слабост могат да бъдат единствената проява на LVH в продължение на много години. Въпреки това, при липса на адекватно лечение на основното заболяване, симптомите постепенно ще се увеличават, което ще доведе до прогресивно намаляване на толерантността към упражнения. Краят на далечната диастолична сърдечна недостатъчност ще бъде развитието на систолична сърдечна недостатъчност, чието лечение е още по-трудно. Така че LVH е директен път към сърдечна недостатъчност, което означава висок риск от ранна сърдечна смърт.

Следващия често усложнение LVH е развитие на пароксизмален предсърдно мъждене (предсърдно мъждене). Нарушаването на релаксация (диастола) на хипертрофираната лява камера неизбежно води до увеличаване на нея кръвно налягане; това от своя страна кара лявото предсърдие да се свива по -силно, за да "изтласка" необходимия обем кръв в "контейнера" с повишено налягане. Лявото предсърдие обаче е тънкостенна сърдечна камера, която не може да работи в суперрежим за дълго време; в крайна сметка лявото предсърдие се разширява (разширява), за да побере излишната кръв. Разширяването на лявото предсърдие е един от най -важните рискови фактори за развитието на предсърдно мъждене. По правило увреждането на лявото предсърдие се проявява дълго време само чрез предсърдна екстрасистолия; впоследствие, когато предсърдието е "достатъчно разширено", за да "поддържа" фибрилацията, настъпва предсърдно мъждене: първо пароксизмално, след това постоянно. Рисковете, които предсърдното мъждене носи за живота на пациента, са описани подробно в отделна глава.
Обструктивен синкоп... Рядък вариант на хода на LVH. Почти винаги е усложнение на асиметричния вариант на хипертрофична кардиомиопатия, когато дебелината на интервентрикуларната преграда е толкова голяма, че съществува заплаха от преходна обструкция (блокиране) на притока на кръв в областта на изходящия тракт вляво вентрикул. Пароксизмалната обструкция (спиране) на притока на кръв на това „критично място“ неизбежно ще доведе до припадък. По правило рискът от развитие на обструкция възниква, когато дебелината на интервентрикуларната преграда надвишава 2 cm.

Камерни преждевременни удари- Друг възможен спътник в LVH. Известно е, че всякакви микро- и макроскопски промени в сърдечния мускул теоретично могат да бъдат усложнени от екстрасистолия. Хипертрофираният миокард е идеален аритмогенен субстрат. Клиничният ход на камерната екстрасистолия на фона на LVH е променлив: по -често ролята му се ограничава до „козметичен аритмичен дефект“. Ако обаче заболяването, водещо до LVH, не се лекува (пренебрегва), не се спазва режимът на ограничаване на интензивната физическа активност, могат да се развият животозастрашаващи камерни аритмии, предизвикани от екстрасистолия.
Внезапна сърдечна смърт.Най -тежкото усложнение на LVH. Най -често това е крайният резултат от LVH на фона на хипертрофична кардиомиопатия. Има две причини. Първо, при това заболяване LVHM може да бъде особено масивен, което прави миокарда изключително аритмогенен. На второ място, хипертрофичната кардиомиопатия много често протича безсимптомно, което не позволява на пациентите да предприемат превантивни мерки предпазни меркипод формата на ограничаване на интензивната физическа активност. Внезапната сърдечна смърт при други нозологии, усложнени от LVH, като цяло е рядка, дори само защото проявата на тези заболявания започва със симптоми на сърдечна недостатъчност, което само по себе си принуждава пациента да се консултира с лекар, което означава, че има реална възможност да се приеме болестта под контрол.
Възможност за регресия на LVH. Вероятността за намаляване на масата (дебелината) на миокарда на лявата камера по време на лечението зависи от причината за хипертрофия и нейната степен. Класически пример е спортното сърце, чиито стени могат да се свият до нормална дебелина след края на спортната кариера.
LVHM поради артериална хипертония или аортна стеноза може успешно да регресира с навременен, пълен и дългосрочен контрол върху тези заболявания. Той обаче се счита по следния начин: само лека хипертрофия претърпява абсолютна регресия; при лечение на хипертрофия среденима шанс да се намали до лек; а тежката може да „стане средна“. С други думи, колкото по -тече процесът, толкова по -малка е вероятността да се върне всичко изцяло към оригинала. Въпреки това, всяка степен на регресия на LVHM автоматично означава коректност в лечението на основното заболяване, което само по себе си намалява рисковете, които хипертрофията носи за живота на субекта.
При хипертрофична кардиомиопатия всякакви опити за коригиране на процеса с медикаменти са безсмислени. Съществуват хирургични подходи за лечение на масивна хипертрофия на интервентрикуларната преграда, която се усложнява от запушване на изходящия тракт на лявата камера.
Вероятността от регресия на LVHM на фона на затлъстяване при възрастни хора с амилоидоза практически липсва.
РќР ° верх
Хипертрофичната кардиомиопатия (HCM) е най -често срещаната кардиомиопатия. Това е генетично обусловено сърдечно заболяване, характеризиращо се със значителна хипертрофия на миокарда на лявата камера, равна на или по -голяма от 15 mm при сърдечен ултразвук. В същото време няма заболявания на сърдечно -съдовата система, които да причинят толкова изразена хипертрофия на миокарда (хипертония, аортна болест на сърцето и др.).
HCM се характеризира със запазване на контрактилната функция на миокарда на лявата камера (често дори увеличаването му), отсъствието на разширяване на кухината му и наличието на изразено нарушение на диастоличната функция на миокарда на лявата камера.
Миокардната хипертрофия може да бъде симетрична (увеличаване на дебелината на стената на цялата лява камера) или асиметрична (увеличаване само на дебелината на стената). В някои случаи се наблюдава само изолирана хипертрофия на горната част на интервентрикуларната преграда директно под фиброзния пръстен на аортната клапа.
В зависимост от наличието или отсъствието на градиент на налягане в изходящия тракт на лявата камера се разграничават обструктивни (стесняващи изходната част на лявата камера) и необструктивна HCM. Обструкцията на изходящия тракт може да бъде локализирана както под аортната клапа (субаортна обструкция), така и на нивото на средата на кухината на лявата камера.
Честотата на HCM в популацията е 1 \ 500 души, по -често в млада възраст; средната възраст на пациентите към момента на диагностициране е около 30 години. Заболяването обаче може да бъде открито много по -късно - на възраст 50-60 години, в единични случаи HCM се открива при лица над 70 години, което е казуистика. Късното откриване на заболяването е свързано с лека тежест на миокардната хипертрофия и отсъствие на значителни промени в интракардиалната хемодинамика. Коронарната атеросклероза се среща при 15-25% от пациентите.
Етиология
HCM е генетично обусловено заболяване, предавано по автозомно доминиращ начин. HCM се причинява от мутация на един от 10 гена, всеки от които кодира специфични протеинови структури на саркомери, състоящи се от тънки и дебели нишки с контрактилни, структурни и регулаторни функции. Най-често HCM се причинява от мутации в 3 гена, кодиращи тежки вериги на бета-миозин (генът се намира на хромозома 14), сърдечен тропонин С (генът се намира на хромозома 1) и миозин-свързващ протеин С (генът се намира на хромозома 11). Мутациите в 7 други гени, отговорни за регулаторния и есенциален миозин на леки вериги, титин, α-тропомиозин, α-актин, сърдечен тропонин I и α-миозин на тежки вериги са много по-редки.
Трябва да се отбележи, че няма директни паралели между естеството на мутацията и клиничните (фенотипни) прояви на HCM. Не всички хора с тези мутации ще имат клинични прояви на HCM, както и признаци на миокардна хипертрофия на ЕКГ и според ултразвуково изследване на сърцето. В същото време е известно, че процентът на преживяемост на пациентите с HCM, произтичащи от мутации в гена на тежка верига бета-миозин, е значително по-нисък, отколкото при мутации в гена на тропонин Т (в тази ситуация болестта се проявява в по-късна възраст ).
Независимо от това, пробандите на пациент с HCM трябва да бъдат информирани за наследствения характер на заболяването и за автозомно -доминантния принцип на предаването му. Освен това роднините от първа линия трябва да бъдат внимателно оценени клинично с помощта на ЕКГ и сърдечен ултразвук.
Най -точният метод за потвърждаване на HCM е ДНК анализ, който може директно да открие мутации в гените. Понастоящем обаче, поради сложността и високата цена на тази техника, тя все още не е получила широко разпространение.
Патогенеза
При HCM има 2 основни патологични механизма - нарушение на диастоличната функция на сърцето и при някои пациенти - запушване на изходящия тракт на лявата камера. По време на периода на диастола недостатъчно количество кръв навлиза във вентрикулите поради тяхната лоша разтегливост, което води до бързо покачване на крайното диастолично налягане. При тези условия хиперфункция, хипертрофия, а след това и разширяване на лявото предсърдие се развиват компенсаторно, а с неговата декомпенсация - белодробна хипертония ("пасивен" тип).
Запушването на изхода на лявата камера, което се развива по време на камерната систола, се дължи на два фактора: удебеляване на интервентрикуларната преграда (миокардна) и нарушено движение на предната част на митралната клапа. Папиларният мускул се скъсява, клапанният лист се удебелява и обхваща пътищата на изтичане на кръв от лявата камера поради парадоксално движение: по време на систола той се доближава до междукамерната преграда и влиза в контакт с нея. Ето защо субаортната обструкция често се комбинира с митрална регургитация, т.е. с недостатъчност на митралната клапа. Поради запушване на лявата камера през периода на вентрикуларна систола възниква градиент на налягане между кухината на лявата камера и възходящата част на аортата.
От патофизиологична и прогностична гледна точка градиентът на налягането в покой над 30 mm Hg е значителен. При някои пациенти с HCM градиентът на налягането може да се увеличи само по време на физическо натоварване и да бъде нормален в покой. При други пациенти градиентът на налягането постоянно се увеличава, включително в покой, което е по -неблагоприятно прогностично. В зависимост от естеството и степента на увеличаване на градиента на налягането, пациентите с HCM се разделят на:
Пациенти с трайна обструкция на изхода, при които градиентът на налягането постоянно, включително в покой, надвишава 30 mm Hg. (2,7 m / s с доплеров ултразвук);
Пациенти с латентна обструкция на изхода, при които в покой градиентът на налягането е по -малък от 30 mm Hg, и по време на провокативни тестове с физическо (трейдмилтест, велоергометрия) или фармакологично (добутамин) натоварване, градиентът на налягането надвишава 30 mm Hg.;
Пациенти без запушване на изхода, при които както в покой, така и по време на провокативни тестове с физически или фармакологичен стрес, градиентът на налягането не надвишава 30 mm Hg.
Трябва да се има предвид, че градиентът на налягане при един и същ пациент може да варира в широки граници в зависимост от различни физиологични състояния (почивка, физическа активност, прием на храна, алкохол и др.).
Постоянно съществуващият градиент на налягане води до прекомерно напрежение на миокарда на лявата камера, появата на неговата исхемия, смърт на кардиомиоцитите и заместването им от фиброзна тъкан. В резултат на това освен тежка диастолна дисфункция, дължаща се на скованост на хипертрофирания миокард на лявата камера, се развива систолична дисфункция на миокарда на лявата камера, което в крайна сметка води до хронична сърдечна недостатъчност.
Клинична картина
HCM се характеризира със следния клиничен ход:
Стабилно състояние на пациентите за дълго време, докато около 25% от пациентите с HCM имат нормална продължителност на живота;
Внезапна сърдечна смърт поради фатални камерни аритмии (камерна тахикардия, камерна фибрилация), рискът от която при пациенти с HCM е доста висок;
Прогресиране на клиничните прояви на заболяването със запазена систолична функция на лявата камера: недостиг на въздух при физическо натоварване, болка в областта на сърцето с ангинален или атипичен характер, нарушено съзнание (припадък, замаяност, замаяност);
Началото и прогресията на хронична сърдечна недостатъчност до терминалния (NYHA функционален клас IV) етап, придружен от систолична дисфункция и ремоделиране на лявата камера на сърцето;
Появата на предсърдно мъждене и характерните му усложнения (исхемичен инсулт и друга системна тромбоемболия);
Началото на IE, което усложнява хода на HCM при 5-9% от пациентите (с атипичен ход на IE с по-често увреждане на митралната, отколкото аортната клапа).
Пациентите с HCM се характеризират с изключително разнообразие от симптоми, което е причина за погрешна диагноза. Често те се диагностицират с ревматично сърдечно заболяване и исхемична болест на сърцето в резултат на сходството на оплакванията (болка в сърцето и зад гръдната кост) и данните от изследванията (интензивен систоличен шум).
В типични случаи клинична картинагрим:
Оплаквания от недостиг на въздух по време на физическо натоварване и намаляване на толерантността към тях, болки в сърцето, както ангинални, така и други, епизоди на замаяност, пресинкопален или синкоп;
Признаци на камерна хипертрофия на миокарда (главно вляво);
Признаци на нарушение на диастоличната функция на вентрикулите;
Признаци на запушване на левия вентрикуларен изходящ тракт (не при всички пациенти);
Нарушения на сърдечния ритъм (най -често предсърдно мъждене). Необходимо е да се вземе предвид определен етап от курса на HCMP. Първоначално, когато градиентът на налягането в изходящия тракт на лявата камера не надвишава 25-30 mm Hg, оплакванията обикновено липсват. С увеличаване на градиента на налягане до 35-40 mm Hg. има оплаквания за намалена поносимост към упражнения. Когато градиентът на налягане достигне 45-50 mm Hg. пациент с HCM има оплаквания от задух, сърцебиене, стенокардия и припадък. При много висок градиент на налягане (> = 80 mm Hg) се увеличават хемодинамичните, мозъчно -съдовите и аритмичните нарушения.
Във връзка с горното информацията, получена на различните етапи от диагностичното търсене, може да бъде много различна.
Скоро първият етап от диагностичното търсенене може да има оплаквания. При тежки нарушения на сърдечната хемодинамика пациентите имат следните оплаквания:
Затруднено дишане по време на тренировка, обикновено умерено изразено, но понякога тежко (предимно поради диастолична дисфункция на лявата камера), проявяваща се в нарушена диастолична релаксация поради повишена миокардна скованост и в резултат на това води до намаляване на запълването на лявата камера по време на диастола , което от своя страна води до повишаване на налягането в лявото предсърдие и крайно диастолично налягане в лявата камера, застой на кръвта в белите дробове, поява на задух и намаляване на толерантността към упражнения);
За болка в областта на сърцето, както с типичен ангинален характер, така и с нетипичен:
Типичните ангинални болки зад гръдната кост от компресиращ характер, възникващи по време на физическо натоварване и по -рядко в покой, са прояви на миокардна исхемия, възникнали в резултат на несъразмерността между повишената нужда от хипертрофиран миокард от кислород и намаления приток на кръв в миокарда на лявата камера поради лошата си диастолична релаксация;
В допълнение, хипертрофия на средите на малки интрамурални коронарни артерии, водещи до стесняване на техния лумен при липса на атеросклеротични лезии, може да играе определена роля в развитието на миокардна исхемия;
И накрая, при лица над 40 години, които имат рискови фактори за развитие на коронарна артериална болест, не може да се изключи комбинация от увеличаване на коронарната атеросклероза и HCM;
Замаяност, главоболие, склонност към припадък
Последица от внезапно намаляване на сърдечния дебит или пароксизми на аритмии, които също намаляват продукцията от лявата камера и водят до временно нарушение на мозъчното кръвообращение;
Нарушения на сърдечния ритъм, най -често пароксизми на предсърдно мъждене, камерни преждевременни удари, PT.
Тези симптоми се наблюдават при пациенти с тежка HCM. При лека хипертрофия на миокарда, леко намаляване на диастоличната функция и липса на запушване на изхода на лявата камера, може да няма оплаквания и тогава HCM се диагностицира случайно. Въпреки това, при някои пациенти с достатъчно изразени промени в сърцето, симптоматиката е неясна: болката в областта на сърцето е болки, шевове, достатъчно дълго.
При нарушения на сърдечния ритъм се появяват оплаквания от прекъсвания, замаяност, припадък, преходен задух. В анамнезата не е възможно появата на симптоми на заболяването да се свърже с интоксикация, предишна инфекция, злоупотреба с алкохол или други патогенни ефекти.
Ха втори етап на диагностично търсененай -значимото е откриването на систоличен шум, променен пулс и изместен апикален импулс.
При аускултация се разкриват следните характеристики:
Максималното звучене на систоличния шум (шум при изтласкване) се определя в точката на Боткин и на върха на сърцето;
Систоличният шум в повечето случаи се увеличава с рязко покачване на пациента, както и по време на теста на Valsalva;
II тон винаги се запазва;
Шумът не се провежда по съдовете на шията.
Пулсът при около 1/3 от пациентите е висок, бърз, което се обяснява с липсата на стесняване в пътищата на изтичане от лявата камера в самото начало на систолата, но след това поради свиването на мощни мускули, " функционално "се появява стесняване на изходящите пътища, което води до преждевременно намаляване на пулсовите вълни.
Апикалният импулс в 34% от случаите има "двоен" характер: първо при палпация се усеща шок от свиването на лявото предсърдие, след това от свиването на лявата камера. Тези свойства на апикалния импулс се разкриват по -добре в положението на пациента, лежащ от лявата страна.
На трети етап на диагностично търсенеДанните от EchoCG са от най -голямо значение:
Хипертрофия на стената на миокарда на лявата камера, надвишаваща 15 mm, при липса на други видими причини, които могат да я причинят (хипертония, клапна болест на сърцето);
Асиметрична хипертрофия на интервентрикуларната преграда, по -изразена в горната трета;
Систолично движение на предния връх на митралната клапа, насочено напред;
Контакт на предния връх на митралната клапа с интервентрикуларната преграда в диастола;
Малък размер на кухината на лявата камера.
Неспецифичните признаци включват увеличаване на размера на лявото предсърдие, хипертрофия на задната стена на лявата камера и намаляване на средната скорост на диастолична оклузия на предната част на митралната клапа.
Промените в ЕКГ зависят от тежестта на хипертрофията на лявата камера. При лека хипертрофия не се откриват специфични промени на ЕКГ. При достатъчно развита хипертрофия на лявата камера, нейните признаци могат да се появят на ЕКГ. Изолираната хипертрофия на интервентрикуларната преграда причинява появата на Q вълна с повишена амплитуда в левите гръдни канали (V 5 -V 6), което усложнява диференциалната диагноза с фокални промени, дължащи се на миокарден инфаркт. Зъбът обаче 0 не е широк, което прави възможно изключването на прехвърления MI. В хода на еволюцията на кардиомиопатията и развитието на хемодинамично претоварване на лявото предсърдие на ЕКГ могат да се появят признаци на синдром на хипертрофия на лявото предсърдие: разширяване на зъбите Pповече от 0,10 s, увеличаване на амплитудата на P вълната, появата на двуфазна вълна Pв извод V 1 с увеличена амплитуда и продължителност на втората фаза.
За всички форми на HCM общ симптом е честото развитие на пароксизми на предсърдно мъждене и камерни аритмии (екстрасистолия и PT). При ежедневен мониторинг (холтеров мониторинг) на ЕКГ, тези сърдечни аритмии са добре документирани. При 25-50% от пациентите се откриват суправентрикуларни аритмии, при 25% - камерна тахикардия.
Рентгеновото изследване в напреднал стадий на заболяването може да разкрие увеличаване на лявата камера и лявото предсърдие, уголемяване на възходящата част на аортата. Увеличаването на лявата камера корелира с височината на налягането в лявата камера.
При PCG се запазват (и дори увеличават) амплитудите на I и II тонове, което отличава HCM от стенозата на аортното отвор, причинена от сливането на клапанните листчета (придобит дефект), а също така се открива и систоличен шум с различна тежест.
Кривата на каротидния пулс, за разлика от нормата, е двупикова, с допълнителна вълна във възход. Такава типична картина се наблюдава само с градиент на налягане "лява камера-аорта", равен на 30 mm Hg. При по -голяма степен на стеноза поради рязко стесняване на изходящия тракт, на каротидната сфигмограма се определя само един плитък връх.
Понастоящем не се изискват инвазивни методи на изследване (сондиране на лявото сърце, контрастна ангиография), тъй като ехокардиографията предоставя доста надеждна информация за поставяне на диагноза. Тя ви позволява да идентифицирате всички признаци, характерни за HCM.
Сърдечно сканиране (с радиоизотоп на талий) помага да се открие удебеляване на интервентрикуларната преграда и свободната стена на лявата камера.
Тъй като 15-25% от пациентите са диагностицирани с коронарна атеросклероза, тогава при възрастни хора с пристъпи на типична ангинална болка трябва да се извърши коронарна ангиография, тъй като тези симптоми, както вече споменахме, при HCM обикновено се причиняват от самото заболяване.
Диагностика
Диагнозата се основава на идентифицирането на типичните клинични проявленияи данни от инструментални методи на изследване (главно ултразвук и ЕКГ).
HCM се характеризира със следните последователно открити симптоми:
Систоличен шум с епицентър на левия ръб на гръдната кост в комбинация със запазен II тон; запазване на I и II тонове на PCG в комбинация с мезосистоличен шум;
Тежка хипертрофия на лявата камера според данните от ЕКГ;
Типични признаци, открити при ехокардиография.
В диагностично трудни случаи се показват коронарна ангиография и МСКТ на сърцето с контраст. Диагностичните трудности се дължат на факта, че индивидуалните симптоми на HCM могат да се появят при голямо разнообразие от заболявания. Ето защо окончателна диагноза HCM е възможен само при задължително изключване на следните заболявания: стеноза на аортния отвор (клапна), недостатъчност на митралната клапа, исхемична болест на сърцето, хипертония.
Лечение
Задачите за лечение на пациенти с HCM включват:
Осигуряване на симптоматично подобрение и удължаване на живота на пациентите чрез въздействие върху основните хемодинамични нарушения;
Лечение на евентуална ангина пекторис, тромбоемболични и неврологични усложнения;
Намаляване на тежестта на миокардната хипертрофия;
Превенция и лечение на аритмии, сърдечна недостатъчност, предотвратяване на внезапна смърт.
Въпросът за целесъобразността на лечението на всички пациенти остава спорен. Пациенти с неусложнена фамилна анамнеза, без изразени прояви на хипертрофия на лявата камера (според ЕКГ и EchoCG), са показани животозастрашаващи аритмии диспансерно наблюдениесъс систематична ЕКГ и ЕхоКГ. Те трябва да избягват значителна физическа активност.
Съвременните възможности за лечение на пациенти с HCM включват медикаментозна терапия (бета-блокери, блокери на Ca-канали, антиаритмични лекарства, лекарства, използвани за лечение на сърдечна недостатъчност, предотвратяване на тромбоемболични усложнения и др.), Хирургично лечение при пациенти с тежка обструкция на изхода на лявата камера тракт (септална миектомия, алкохолна аблация на интервентрикуларната преграда) и използването на имплантируеми устройства (ICD и двукамерни пейсмейкъри).
Медикаментозно лечение
Лекарствата от първа линия при лечението на пациенти с HCM са бета-блокери, които намаляват градиента на налягането (възникващ или нарастващ по време на тренировка) и миокардната нужда от кислород, удължават времето за диастолично запълване и подобряват вентрикуларното запълване. Тези лекарства могат да бъдат разпознати като патогенетични, тъй като имат и антиангинални и антиисхемични ефекти. Могат да се използват различни краткодействащи и дългодействащи бета-блокери: пропранолол в доза 40-200 mg / ден, метопролол (метопрололов тартарат) в доза 100-200 mg / ден, бисопролол в доза 5- 10 mg / ден.
При редица пациенти, при които бета-блокерите не са били ефективни или назначаването им е невъзможно (изразена бронхиална обструкция), могат да се предписват краткодействащи калциеви антагонисти-верапамил в доза 120-360 mg / ден. Те подобряват релаксацията на миокарда на лявата камера, увеличават запълването му по време на диастола, освен това използването им се дължи на отрицателен инотропен ефект върху вентрикуларния миокард, което води до антиангинален и антиисхемичен ефект.
При наличие на нарушения на камерния ритъм и недостатъчна антиаритмична ефикасност на бета-блокерите, амиодарон (кордарон) се предписва в доза от 600-800 mg / ден през първата седмица, след това 200-400 mg / ден (под контрола на Холтер мониторинг).
С развитието на сърдечна недостатъчност се предписват диуретици (хидрохлоротиазид, фуроземид, торасемид) и алдостеронови антагонисти: верошпирон *, спиронолактон (алдактон *) в необходимите дози.
При обструктивна HCM трябва да се избягват сърдечни гликозиди, нитрати, симпатикомиметици.
Хирургия
Той се проявява при приблизително 5% от всички пациенти с HCM, при наличие на тежка обструкция на изхода на лявата камера, когато градиентът на пиковото налягане, според ултразвук с Доплер, надвишава 50 mm Hg. в покой тежки клинични симптоми продължават (синкоп, задух, ангина пекторис, сърдечна недостатъчност), въпреки максимално възможната лекарствена терапия.
Докато правите септална миектомиямалка част от миокарда (5-10 g) на проксималната интервентрикуларна преграда се резецира, започвайки от основата на аортния пръстен до дисталния ръб на листовете на митралната клапа. В същото време изходният участък на лявата камера се разширява, обструкцията му се елиминира и в същото време се елиминира относителната недостатъчност на митралната клапа и митралната регургитация, което води до намаляване на крайното диастолично налягане в лявата вентрикул и намаляване на задръстванията в белите дробове. Оперативната смъртност по време на тази хирургична интервенция е ниска, възлизаща на 1-3%.
Перкутанна транслуминална алкохолна миокардна аблацияИнтервентрикуларната преграда е предложена през 1995 г. като алтернатива на септалната миектомия. Показанията за употребата му са същите като при септалната миектомия. Този метод се основава на създаването на оклузия на един от септалните клони на предната интервентрикуларна коронарна артерия, която доставя кръв към онези части на интервентрикуларната преграда, които са отговорни за запушването на изхода на лявата камера и градиента на налягането. За тази цел малко (1,0-3,0 ml) количество етанол се инжектира в избраната септална артерия, използвайки техниката на перкутанна коронарна интервенция (PCI). Това води до появата на изкуствена некроза, т.е. ИМ на частта от интервентрикуларната преграда, отговорна за образуването на запушване на изхода на лявата камера. В резултат на това степента на хипертрофия на интервентрикуларната преграда намалява, изходните участъци на лявата камера се разширяват и градиентът на налягането намалява. Оперативната смъртност е приблизително същата като при миектомия (1-4%), но при 5-30% от пациентите се налага имплантиране на пейсмейкър поради развитието на атриовентрикуларен блок II-III степен.
Друг метод за хирургично лечение на пациенти с HCM е имплантиране на двукамерен (атриовентрикуларен) пейсмейкър.Когато електрическото стимулиране се извършва от върха на дясната камера, нормалната последователност на свиване на различни части на сърцето се променя: първоначално настъпва активиране и свиване на върха на сърцето и едва след това, с известно забавяне, активиране и свиване на базалните части на лявата камера. При някои пациенти с обструкция на изхода на лявата камера това може да бъде придружено от намаляване на амплитудата на движение на базалните участъци на интервентрикуларната преграда и да доведе до намаляване на градиента на налягането. В този случай е необходима много внимателна индивидуална настройка на пейсмейкъра, включително търсене на оптималната стойност на атриовентрикуларното забавяне. Имплантирането на двукамерен пейсмейкър не е първият избор при лечението на пациенти с HCM. Използва се доста рядко при избрани пациенти на възраст над 65 години, с тежки клинични симптоми, резистентни към медикаментозна терапия, при които е невъзможно да се извърши миектомия или перкутанна транслуминална алкохолна аблация на миокарда на интервентрикуларната преграда.
Предотвратяване на внезапна сърдечна смърт
Сред всички пациенти с HCM има относително малка група пациенти, характеризиращи се с висок риск от внезапна сърдечна смърт, причинена от камерни тахиаритмии (камерно мъждене, камерна тахикардия). Тя включва следните пациенти с HCM:
Отложено преди това спиране на кръвообращението;
Предишни епизоди на спонтанно възникваща и персистираща (продължаваща повече от 30 секунди) камерна тахикардия;
Тези, които имат сред близки роднини на лица, страдащи от HCM и внезапно починали;
Страдащи от необясними епизоди на загуба на съзнание (синкоп), особено ако са млади хора, и синкопът се появява многократно по време на физическо натоварване;
След регистрирани епизоди на нестабилна камерна тахикардия (3 последователни камерни екстрасистоли или повече) с честота над 120 на минута по време на 24-часово холтерово ЕКГ наблюдение;
Лица, които в отговор на физическа активност, извършена в изправено положение, развиват артериална хипотония, особено млади пациенти с HCM (под 50 години);
С изключително изразена хипертрофия на миокарда на лявата камера над 30 mm, особено при млади пациенти.
Според съвременните схващания за такива пациенти с HCM, които имат висок риск от внезапна сърдечна смърт, с цел нейната първична профилактика е показано имплантиране на кардиовертер-дефибрилатор. Той е още по -показан с цел вторична профилактика на внезапна сърдечна смърт при пациенти с HCM, които вече веднъж са претърпели сърдечен арест или епизоди на спонтанно възникваща и персистираща камерна тахикардия.
Прогноза
Годишната смъртност е 3-8%, като в 50% от тези случаи настъпва внезапна смърт. Пациентите в напреднала възраст умират от прогресираща сърдечна недостатъчност, а младите пациенти умират внезапно поради развитието на пароксизми на камерна тахикардия или камерно мъждене, по -рядко поради миокарден инфаркт (който може да възникне и при малко променени коронарни артерии). Повишената обструкция на изхода на лявата камера или намаленото запълване по време на тренировка също могат да причинят внезапна смърт.
Предотвратяване
Мерките за първична превенция не са известни.
Хипертрофия на миокарда (хипертрофична кардиомиопатия) е значително удебеляване и разширяване на стените на лявата камера на сърцето. В същото време кухината му вътре не се разширява. В повечето случаи е възможно и удебеляване на интервентрикуларните прегради.
Поради удебеляването, сърдечният мускул става по -малко разтеглив. Миокардът може да бъде удебелен по цялата повърхност или в някои области, всичко зависи от хода на заболяването:
- Ако миокардът хипертрофира предимно под аортния изход, може да възникне стесняване на изхода на лявата камера. В този случай вътрешната обвивка на сърцето се удебелява, работата на клапаните се нарушава. В повечето случаи това се случва с неравномерно удебеляване.
- Асиметрично удебеляване на преградата е възможно без смущения в клапанния апарат и намаляване на изхода от лявата камера.
- Апикалната хипертрофична кардиомиопатия възниква в резултат на увеличаване на мускулите на върха на сърцето.
- Хипертрофия на миокарда със симетрична кръгова хипертрофия на лявата камера.
История на заболяването
Хипертрофичната кардиомиопатия е известна от средата на 19 век. Той успява да го опише подробно едва през 1958 г. от английския учен Р. Теаре.
Значителен напредък в изследването на болестта е въвеждането на някои неинвазивни методи на изследване, когато те научават за съществуването на запушване на изходящия тракт и дистолична дисфункция.
Това е отразено в съответните имена на заболяването: „идиопатична хипертрофична субаортална стеноза“, „мускулна субаортна стеноза“, „хипертрофична обструктивна кардиомиопатия“. Днес терминът "хипертрофична кардиомиопатия" е универсален и общоприет.
С широкото въвеждане на ECHO KG проучвания беше установено, че броят на пациентите с миокардна хипертрофия е много по -висок, отколкото се смяташе през 70 -те години. Всяка година 3-8% от пациентите с това заболяване умират. И смъртността нараства всяка година.
Разпространение и значение
Най-често хората на възраст 20-40 години страдат от хипертрофия на миокарда, мъжете са около два пъти по-склонни.Прогресирайки много разнообразно, напредвайки, болестта не винаги се проявява веднага. В редки случаи, от самото начало на хода на заболяването, състоянието на пациента е сериозно и рискът от внезапна смърт е доста висок.

Честотата на хипертрофична кардиомиопатия е около 0,2%. Смъртността варира от 2 до 8%. Основната причина за смъртта е внезапна сърдечна смърт и животозастрашаващи нарушения на сърдечния ритъм. Основната причина е наследствената предразположеност. Ако близките не са страдали от това заболяване, те смятат, че е настъпила мутация на гените на протеините на сърдечния мускул.
Болестта може да бъде диагностицирана на всяка възраст: от раждането до старостта, но най -често пациентите са млади хора в трудоспособна възраст. Разпространението на миокардната хипертрофия не зависи от пола и расата.
При 5-10% от всички регистрирани пациенти с продължителен ход на заболяването е възможен преход към сърдечна недостатъчност. В някои случаи при същия брой пациенти е възможна независима регресия на хипертрофия, преход от хипертрофична към разширена форма. Същият брой случаи обясняват възникващите усложнения под формата на инфекциозен ендокардит.
Без подходящо лечение смъртността е до 8%. В половината от случаите смъртта настъпва в резултат на остър инфаркт, вентрикуларна фибрилация и пълен атриовентрикуларен сърдечен блок.
Класификация
В съответствие с мястото на локализация на хипертрофия се разграничава миокардна химетрофия:
- лява камера (асиметрична и симетрична хипертрофия);
- дясна камера.
По принцип асиметрична хипертрофия на интервентрикуларната преграда се открива по цялата повърхност или в някои от нейните части. По -рядко може да се открие хипертрофия на върха на сърцето, антеролатералната или задната стена. Симетричната хипертрофия представлява 30% от случаите.
Като се вземе предвид градиентът на систоличното налягане в лявата камера, се различава хипертрофична кардиомиопатия:
- обструктивен;
- необструктивен.

По правило симетричната хипертрофия на лявата камера се отнася до необструктивна форма на миокардна хипертрофия.
Асиметричната хипертрофия може да се отнася както за обструктивни, така и за необструктивни форми. Апикалната хипертрофия се отнася главно до необструктивния вариант.
В зависимост от степента на удебеляване на сърдечния мускул се разграничава хипертрофия:
- умерен (до 20 мм);
- среден (21-25 мм);
- изразено (повече от 25 мм).
Въз основа на клинични и физиологични класификации се разграничават 4 етапа на миокардна хипертрофия:
- I - градиент на налягане на изхода на лявата камера не повече от 25 mm Hg. Изкуство. (без оплаквания);
- II - градиентът се увеличава до 36 mm Hg. Чл. (Поява на оплаквания по време на физическо натоварване);
- III - градиентът се увеличава до 44 mm Hg. Чл. (Появява се задух и стенокардия);
- IV - градиент над 80 mm Hg. Изкуство. (нарушение на хемодинамиката, възможна внезапна смърт).

Хипертрофия на лявото предсърдие е заболяване, при което има удебеляване на лявата камера на сърцето, поради което повърхността губи своята еластичност.
Ако уплътняването на сърдечната преграда е настъпило неравномерно, освен това могат да възникнат и нарушения в работата на аортната и митралната клапа на сърцето.
Днес критерият за хипертрофия е удебеляване на миокарда от 1,5 cm или повече. Това заболяване в момента е водещата причина за ранна смърт при млади спортисти.
С болестта се появява хипертрофична кардиомиопатия, удебеляването на стените на сърцето, обемът на изпомпваната кръв намалява. Пациентът често не забелязва никакви симптоми или чувства малка слабост, замаяност. Хипертрофията на сърдечния мускул обаче е много опасна, тъй като може да доведе до внезапен сърдечен арест.
Хипертрофична кардиомиопатия - какво е това?
Тази патология на сърцето в повечето случаи засяга мускулите на лявата камера и много по -рядко дясната. Мускулната субаортална стеноза или хипертрофична кардиомиопатия е тежко сърдечно -съдово заболяване, при което удебеляването, фиброзата на миокарда настъпва с намаляване на интервентрикуларното пространство. Кодът по МКБ е 142. Мъжете на възраст от 20 до 50 са по -склонни да страдат от патология.
По време на заболяването се нарушава диастоличната функция, възниква дистрофия на миокардните стени. 50% от пациентите не могат да бъдат спасени. На някои се помага лекарства, а останалите трябва да преминат през сложна операция за отстраняване на хипертрофирана или удебелена тъкан. Има няколко форми на заболяването:
- Симетрично. Тя може да се характеризира с едновременна пролиферация на миокарда. Вариант на тази форма е концентричен, когато увеличението е разположено в кръг.
- Асиметрични. Удебеляването на стените се случва неравномерно, в повечето случаи в интервентрикуларната преграда (IVS), горна, долна или средна част. Задната стена не се променя.
Причини за хипертрофична кардиомиопатия
Сред причините за HCM лекарите назовават фамилен наследствен фактор. Наследените дефектни гени могат да кодират синтеза на миокарден контрактилен протеин. Съществува възможност за генна мутация поради външни влияния. Други възможни причини за хипертрофична кардиомиопатия са:
- хипертонични разстройства;
- белодробни заболявания;
- исхемична болест;
- силен стрес;
- бивентрикуларна сърдечна недостатъчност;
- нарушение на ритъма;
- прекомерна физическа активност;
- възраст след 20 години.
Хипертрофична кардиомиопатия при деца
Според лекарите първичната хипертрофична кардиомиопатия при деца възниква поради вроден дефект. В други случаи заболяването се развива, когато майката, докато носи детето, е претърпяла тежка инфекция, била е изложена на радиация, пушила е или е пила алкохол. Ранната диагностика в болницата ви позволява да определите лезията при детето в първите дни след раждането.

Хипертрофична кардиомиопатия - симптоми
Видът на заболяването засяга симптомите на хипертрофична кардиомиопатия. При необструктивен пациент пациентът не изпитва дискомфорт, тъй като притока на кръв не се нарушава. Тази форма се счита за асимптоматична. При обструктивна форма пациентът проявява симптоми на кардиомиопатия:
- виене на свят;
- диспнея;
- висок пулс;
- припадък;
- болка в гърдите;
- систоличен шум;
- белодробен оток;
- артериална хипотония;
- възпалено гърло.
Пациент, който знае какво е сърдечна хипертрофия, проявите на болестта са добре известни. Тези признаци се обясняват с факта, че болестта не позволява на сърцето да се справи с работата както преди, човешките органи са слабо снабдени с кислород. Ако такива симптоми се усещат, трябва да се консултирате с кардиолог за съвет.
Хипертрофична кардиомиопатия - диагностика
Няма достатъчно визуални признаци за откриване на заболяване. Необходима е диагностика на хипертрофична кардиомиопатия, която се извършва с помощта на медицински устройства. Такива методи на изследване включват:
- Рентгенография. Снимката показва контурите на сърцето, ако са увеличени, това може да е хипертрофия. Въпреки това, когато миокардната хипертрофия се развие вътре в органа, разстройството може да не се види.
- ЯМР или магнитен резонанс. Помага да се изследва сърдечната кухина в триизмерно изображение, да се види дебелината на всяка от стените, степента на запушване.
- ЕКГ дава представа за колебанията в сърдечните ритми на човек. Лекар с богат опит в кардиологията може правилно да прочете показанията на електрокардиограмата.
- Ехокардиографията или ултразвукът на сърцето се използва по -често от други методи, той дава точна картина на размера на сърдечните камери, клапите, вентрикулите и преградите.
- Фонокардиограма помага да се запишат шумовете, които се произвеждат от различни части на органа, и да се установи връзка между тях.
Най -простият диагностичен метод остава подробен биохимичен кръвен тест. Според неговите резултати лекарят може да прецени нивото на захарта и холестерола. Съществува и инвазивен метод, който помага за измерване на налягането във вентрикулите и предсърдията. В сърдечната кухина се вкарва катетър със специални сензори. Методът се използва, когато трябва да вземете материал за изследване (биопсия).

Хипертрофична кардиомиопатия - лечение
Лечението на хипертрофична кардиомиопатия е разделено на медицинско и хирургично. Лекарят решава кой метод да използва, в зависимост от тежестта на заболяването. Лекарствата, които облекчават състоянието на пациента в началния етап, включват:
- бета-блокери (пропранолол, метопролол, атенолол);
- лекарства с калциев антагонист;
- антикоагуланти за тромбоемболия;
- средства за аритмия;
- диуретици;
- антибиотици за профилактика на инфекциозен ендокардит.
Хирургичното лечение е показано за пациенти, които имат заболяване във фази 2 и 3 или, при потвърждаване на диагнозата, асиметрична хипертрофия на интервентрикуларната преграда. Сърдечните хирурзи извършват операции:
- Миектомията е отстраняване на уголемена мускулна тъкан в интервентрикуларната преграда. Манипулациите се извършват с отворено сърце.
- Смяна на митралната клапа с изкуствена протеза.
- Етанолна аблация. Под наблюдението на ултразвуков апарат се прави пункция и се инжектира медицински алкохол, който изтънява преградата.
- Инсталиране на пейсмейкър или дефибрилатор.
В допълнение, пациентът трябва напълно да преразгледа начина си на живот:
- Спрете да спортувате и изключете физическата активност.
- Вземете строга диета, която ограничава захарта и солта.
- Редовно (2 пъти годишно) се подлагайте на медицински прегледи, за да предотвратите рецидив на заболяването.

Хипертрофична кардиомиопатия - продължителност на живота
Често болестта се развива при млади мъже, които не контролират физическата активност и хора със затлъстяване. Без медицинска терапия и ограничаване на натоварването прогнозата ще бъде тъжна - кардиомиопатията на сърцето води до внезапна смърт. Смъртността сред пациентите е приблизително 2-4% годишно. При някои пациенти хипертрофичният вид се разширява - наблюдава се увеличение в лявата камера. Според статистиката средната продължителност на живота при хипертрофична кардиомиопатия е 17 години, а в тежка форма - не повече от 3-5 години.
Видео: сърдечна хипертрофия
Хипертрофичната кардиомиопатия, наследствено сърдечно заболяване, е била известна още през деветнадесети век. Но болестта е описана подробно едва през 1958 г. Днес патологията е най -много обща причинавнезапна смърт на спортисти на възраст под тридесет и пет години.
Същността на болестта
Хипертрофичната кардиомиопатия е първично наследствено сърдечно заболяване. Типът наследяване е автозомно доминантно. При пациенти се наблюдава хипертрофия на вентрикулите на сърцето в комбинация с намален обем на техните кухини (въпреки че в някои случаи този показател е нормален).
Заболяването е независимо от други сърдечно -съдови заболявания. С него има удебеляване на миокарда на дясната или лявата камера. Както бе споменато по -рано, болестта често засяга лявата камера.
Разположението на кардиомиоцитите при пациенти с хипертрофична кардиомиопатия е нарушено. Наблюдава се и миокардна фиброза. В повечето случаи хипертрофията засяга интервентрикуларната преграда. По -рядко - върхът и средният сегмент на вентрикула на сърцето (в тридесет процента от случаите нарушения се наблюдават само в един сегмент).
Заболяването се счита за семейно заболяване и се предава директно от един член на семейството на друг. Но понякога има спорадични случаи на хипертрофична кардиомиопатия. И в двата случая основната причина за сърдечно заболяване е генен дефект.
Установено е, че генните мутации, които провокират развитието на болестта, се отнасят до протеините на миофибрилите. Механизмът на този ефект обаче все още е неясен. В допълнение, сегашното ниво на развитие на научните познания не дава възможност да се обясни защо хората със същите мутации развиват сърдечни заболявания с различна тежест.
Хипертрофичната кардиомиопатия засяга приблизително 0,2 до 1,1 процента от населението. Мъжете са по -склонни да се сблъскат с това заболяване (приблизително два пъти). Повечето от диагностицираните случаи се отнасят до пациенти на възраст между тридесет и петдесет години.
В петнадесет до двадесет и пет процента от случаите заболяването е придружено от коронарна атеросклероза. Пет до девет процента от пациентите страдат от възникване като усложнение на хипертрофична кардиомиопатия. В този случай заболяването засяга митралната и / или аортната клапа.
Класификация
Значителният полиморфизъм на симптомите на заболяването затруднява поставянето на точна диагноза. Заболяванията са податливи на всички възрастови групи от населението, въпреки че по-често хората страдат от хипертрофична кардиомиопатия, на възраст от двадесет и две до двадесет и пет години. На първо място, заболяването е разделено на HCM на дясната и лявата камера на сърцето. В първия случай заболяването може да бъде симетрично или асиметрично (най -често наблюдаваното явление).
В зависимост от градиента на систоличното налягане в лявата камера се разграничават две форми на HCM на сърцето: обструктивна или необструктивна. При симетрична LF хипертрофия най-често се наблюдава необструктивна форма. Асиметричната форма на заболяването (субаортална подклапална стеноза) е по -често обструктивна.

В момента следната клинична и физиологична класификация на обструктивната форма на хипертрофична болест на сърцето се счита за общоприета:
- Първият етап на хипертрофична кардиомиопатия. Наблюдава се, когато градиентът на налягането в изходящия тракт на лявата камера на сърцето не е по-висок от двадесет и пет милиметра живак. В повечето случаи пациентите не наблюдават смущения от организма на този етап, така че няма оплаквания от тях.
- Вторият етап на хипертрофична кардиомиопатия. HD не е по-висока от тридесет и шест милиметра живак. За разлика от предишния етап, на този етап пациентът може да наблюдава влошаване на благосъстоянието след физическо натоварване.
- Третият етап на хипертрофична кардиомиопатия. Наблюдава се увеличение на HD до четиридесет и четири милиметра живак. При пациенти се проявява задух.
- Четвъртият етап на хипертрофична кардиомиопатия. HD е над четиридесет и пет милиметра живак. В някои случаи той се издига до критично ниво (сто осемдесет и пет милиметра живак). Наблюдават се геодинамични нарушения. На този етап е възможна смърт на пациента.
Съществува и класификация на заболяването, която се основава на такъв параметър като степента на удебеляване на сърдечния миокард. С показател от петнадесет до двадесет милиметра се диагностицира умерена форма на заболяването. С дебелина на миокарда от двадесет и един до двадесет и пет милиметра, има средна хипертрофична кардиомиопатия на сърцето. Тежка хипертрофия се наблюдава с удебеляване на миокарда с повече от двадесет и пет милиметра.

Обструкция при хипертрофична кардиомиопатия
Хипертрофичната обструктивна кардиомиопатия се характеризира с комбинация от дифузна хипертрофия на LV стената на сърцето с непропорционална хипертрофия на две трети (горна) интервентрикуларна преграда. Поради това има стесняване на пътя, по който се случва изтичането на кръв от LV. Това заболяване се обозначава с термина обструкция (стеноза).
При HCM обструкцията, ако има такава, е динамична. Промените могат да настъпят дори между посещенията на лекар. Тежестта на обструкцията може да варира между сърдечните удари. Въпреки че подобен процес се проявява и при други заболявания, той е по -често срещан в случай на развитие на това заболяване.
Днес лекарите идентифицират три механизма за възникване на хипертрофична кардиомиопатия:
- Повишената контрактилитет на ЛК е причина за намаляване на систоличния обем. По пътя се увеличава скоростта на освобождаване на кръв. Поради това митралната клапа започва да се движи в обратна посока към преградата.
- Намаленият обем на лявата камера на сърцето води до намаляване на размера на изходящия тракт.
- Намаленото съпротивление на кръвния поток в аортата води до увеличаване на скоростта му в субаорталната област и намаляване на систоличния обем на камерата.
 Наблюдава се увеличаване на обструкцията на заболяването поради физическа активност, въвеждане на изопротеренол, тест на Valsalva, прием на нитроглицерин, тахикардия. Тоест влошаването е причина за ефектите на фактори, които увеличават свиването на вентрикула на сърцето и намаляват обема му.
Наблюдава се увеличаване на обструкцията на заболяването поради физическа активност, въвеждане на изопротеренол, тест на Valsalva, прием на нитроглицерин, тахикардия. Тоест влошаването е причина за ефектите на фактори, които увеличават свиването на вентрикула на сърцето и намаляват обема му.
Запушването намалява с високо кръвно налягане, клекове, продължително напрежение на ръцете и повдигане на долните крайници. Поради увеличения обем на циркулиращата кръв, обемът на вентрикула се увеличава, което води до намаляване на тежестта на хипертрофичната кардиомиопатия.
Внезапна смърт поради развитието на болестта
Повечето хора с това сърдечно заболяване умират в резултат на внезапна смърт. Рискът от такава смърт зависи от възрастта на пациента и редица други фактори. В повечето случаи внезапната смърт при хипертрофична кардиомиопатия настъпва в детска и млада възраст. Хипертрофичната кардиомиопатия рядко причинява смърт при деца под десетгодишна възраст.
Най -често смъртта от заболяване настъпва, когато пациентът е в покой (до шестдесет процента).
В около четиридесет процента от случаите смъртта настъпва след тренировка. В двадесет и два процента от случаите пациентите не са чувствали никакви симптоми преди смъртта и не са подозирали наличието на хипертрофична кардиомиопатия.
Електрическата нестабилност на сърцето (вентрикуларна фибрилация) е най -честата причина за смърт при пациенти с хипертрофична кардиомиопатия. Нестабилността може да бъде предизвикана от:
- Морфологични промени в миокарда (фиброза, дезорганизация).
- Преждевременно възбуждане на LV или RV през латентните пътища.
- Исхемия.
В някои случаи внезапна смърт при хипертрофична кардиомиопатия настъпва поради нарушения на проводимостта. Подобен проблем възниква поради пълен атриовентрикуларен блок или развитие.

Симптоми
При хипертрофична кардиомиопатия симптомите може да не се появят за дълъг период от време. Обикновено първите признаци на заболяването се появяват на възраст между двадесет и пет и четиридесет години. Днес лекарите разграничават девет форми на клиничното протичане на това сърдечно заболяване:
- Светкавично бързо.
- Смесени.
- Псевдоклапан.
- Декомпенсаторно.
- Аритмични.
- Подобно на инфаркт.
- Кардиалгичен.
- Вегетодистон.
- Малосимптомно.
Всички клинични варианти на хода на хипертрофична кардиомиопатия, предоставени по -горе, имат свои характерни симптоми. Има обаче признаци, които са еднакви за всички форми на заболяването.
Така че при необструктивна форма на заболяването се наблюдават само незначителни симптоми. Няма нарушения на изтичането на кръв. Възможна проява на задух, прекъсвания в работата на сърдечния мускул. По време на физически упражнения и натоварвания може да се наблюдава неравномерност на пулса.
Симптомите на обструктивна хипертрофична кардиомиопатия са по -изразени. Седемдесет процента от пациентите развиват ангинална болка. По -голямата част от хората с това сърдечно заболяване изпитват задух (приблизително деветдесет процента от случаите). Половината от пациентите се оплакват от замаяност, припадък. Възможно е и проявление:
- преходна артериална хипертония;
- нарушения на сърдечния ритъм;
- предсърдно мъждене;
- екстрасистоли;

Хипертоничната кардиомиопатия при пациенти в напреднала възраст също може да бъде придружена от артериална хипертония. Точният брой на пациентите не е известен точно, но някои данни показват, че явлението е доста често срещано сред възрастните хора с това сърдечно заболяване.
В някои случаи това заболяване при пациентите е придружено от белодробен оток. Но въпреки всички горепосочени симптоми, доста често единствената проява на HCM при пациентите е внезапна смърт. В този случай по очевидни причини не е възможно да се помогне на пациента.
Диагностика
Първият етап в диагностиката на хипертрофична кардиомиопатия е изключването на други заболявания, които засягат миокарда и имат подобни симптоми. Тези заболявания например включват.
На първо място, лекарят ще изслуша оплакванията на пациента и ще извърши повърхностен преглед. При хипертрофична кардиомиопатия се обръща внимание на шийните вени. Тежестта на вълната А показва наличието на хипертрофия и непоколебимост на RV на сърцето. Претоварването с RV при пациент може да бъде открито и чрез сърдечен импулс. Забелязва се, ако пациентът едновременно развие заболяване като напр.
Следващият етап в диагностиката на хипертрофичната кардиомиопатия е палпацията.ЛИВ хипертрофията може да повлияе и на пресистоличния апикален импулс (съответства на четвъртия тон). В някои случаи пациентите имат троен импулс (причинен от късно систолично подуване на LV). Лекарят може също да подозира наличието на заболяване чрез сондиране на пулса на пациента. При хипертрофична кардиомиопатия бързото нарастване на пулсовата вълна е последвано от втори пик.

С помощта на стетоскоп се изслушва сърцето на пациента. Аномалии в случай на развитие на сърдечни заболявания се наблюдават във втория тон. Парадоксално може да се раздели. В областта на левия ръб на гръдната кост на пациента лекарят може да изслуша систоличен шум.
При хипертрофична кардиомиопатия се чува в гръдната кост, но не се простира до съдовете, разположени в тази област на сърцето и под мишниците на пациента.
Продължителността и тежестта на шума зависи от натоварването. Увеличаването на венозното връщане води до скъсяване, понижаване на систоличния шум. Намаленото запълване на лявата камера на сърцето провокира по -груб, по -продължителен шум.
Хипертрофичната кардиомиопатия не е единственото сърдечно заболяване, което причинява систоличен шум. За да се избегне диагностична грешка, тя трябва да бъде диференцирана. Лекарят може да направи това, като използва следните фармакологични и функционални тестове:
- Тест на Valsalva;
- Амил нитрит;
- Клякам, ръчна преса;
- Фенилефрин.
 Най-често се използват неселективни бета-блокери, като: "Obzidan", "Anaprilin", "Inderal". Типичната дневна доза лекарства е от сто шестдесет до триста и двадесет милиграма. В някои случаи лекарите използват селективни лекарства: "Атенолоп", "Метопролол". В този случай изхвърлянето на конкретно лекарство зависи от специалиста.
Най-често се използват неселективни бета-блокери, като: "Obzidan", "Anaprilin", "Inderal". Типичната дневна доза лекарства е от сто шестдесет до триста и двадесет милиграма. В някои случаи лекарите използват селективни лекарства: "Атенолоп", "Метопролол". В този случай изхвърлянето на конкретно лекарство зависи от специалиста.
Съвременната медицина няма информация за благоприятния ефект на бета-блокерите върху вероятността от внезапна смърт поради развитието на болестта. Няма данни, които да свидетелстват в полза на тази теза днес. Но с помощта на тези лекарства лекарят може да премахне ангина пекторис, задух, припадък. Някои проучвания показват, че ефективността на тази група лекарства е до седемдесет процента.
Възможно е да се използват бета-блокери за лечение на пациенти с хипертрофична кардиомиопатия с обструкция на изходящия тракт. Но има и редица противопоказания. По този начин лекарствата "Carvedilol" и "Labetalol" влияят съдова системаразширяване на кръвоносните съдове. Следователно, лекарите трябва да откажат да ги използват в случай на развитие на това заболяване. При наличие на бронхоспазъм, тежък AV блок или декомпенсирана левокамерна недостатъчност използването на бета-блокери е строго забранено.
Други лекарства, използвани за медицинско лечение
При лечението на болестта лекарите също активно използват калциеви антагонисти. Тези лекарстваповлияват концентрацията на калций в системните коронарни артерии, кардиомиоцитите, като я понижават. В същото време, когато приемате такива лекарства, количеството на веществото в проводящите системи намалява.
С помощта на лекарства от тази група може да се подобри диастоличната релаксация на LV и да се намали контрактилитетът на миокарда. Лекарствата имат подчертан антиаритмичен и антиангинален ефект, като по този начин намаляват нивото на хипертрофия на ЛК.
Препаратите "Изоптин" и "Финоптин" са показали най -голяма ефективност при хипертрофична кардиомиопатия. Типичната дневна доза за лечение на болестта е от сто шестдесет до триста и двадесет милиграма на ден. Добре доказани при лечението на болести "Кардил" и "Кардизем", които се използват в сто осемдесет - двеста и четиридесет милиграма на ден.
 Когато използвате "Амиодарон", началните дневни дози са от шестстотин до хиляда милиграма на ден. След постигане на стабилен антиаритмичен ефект, дозата може да бъде намалена до двеста до триста милиграма. "Ritmilen" се приема по четиристотин милиграма на ден, с постепенно увеличаване на дозата до осемстотин милиграма.
Когато използвате "Амиодарон", началните дневни дози са от шестстотин до хиляда милиграма на ден. След постигане на стабилен антиаритмичен ефект, дозата може да бъде намалена до двеста до триста милиграма. "Ritmilen" се приема по четиристотин милиграма на ден, с постепенно увеличаване на дозата до осемстотин милиграма.
Ако пациентът се развие, лекарят може да използва диуретици. Напоследък терапията на заболяването се провежда и с помощта на АСЕ инхибитори ("Еналаприл"). Използването им е препоръчително, ако пациентът има сърдечна недостатъчност и артериална хипертония.
Забранено е използването на Нифедипин в терапията. Това лекарство може да влоши обструкцията на лявата камера. Но резултатът оправдава риска, ако на фона на заболяването се развие артериална хипертония или други заболявания.
Лекарствената терапия се провежда, ако пациент с хипертрофична кардиомиопатия има тежки симптоми. Възможността за използване на лекарства при липса на признаци на кардиомиопатия е под въпрос. Тъй като няма информация за ефективността на бета-блокерите за предотвратяване на внезапна смърт, продължителната употреба на лекарства при липса на признаци на заболяване се извършва по решение на лекуващия лекар.
Хирургическа интервенция

При лечението на болестта, освен приемането на лекарства, се използват и оперативни техники. Така че, единственият начин за лечение на тежки пациенти, които не са развили обструкция, е сърдечна трансплантация. При наличие на обструкция е възможно да се извърши двукамерен пейсмейкър, миоектомия, подмяна на митралната клапа, разрушаване на интервентрикуларната преграда.
Предишни проучвания върху двукамерен пейсмейкър показват, че използването на метода има благотворителен ефект върху обструкцията на ЛК и благосъстоянието на пациента. Последните събития в тази област обаче поставят под въпрос резултатите от тези проучвания. Ревизията е свързана с отрицателното въздействие на пейсмейкъра (влошаване на вентрикуларното запълване, намален сърдечен дебит).
Освен това последните проучвания доказват, че подобряването на състоянието на пациентите след прилагане на метода до голяма степен се провокира от плацебо ефекта, а не от реални промени в хода на заболяването.
Сравнително нов метод на терапия е разрушаването на интервентрикуларната преграда с помощта на етанол. Прилагането на метода включва въвеждане на един до четири милиграма абсолютен етанол в клона на преградата. Това действие кара пациента да получи инфаркт. В резултат на процедурата има изтъняване на преградата и акинезия, което намалява или напълно премахва запушването.
Повече от четиридесет години хипертрофичната кардиомиопатия се лекува с операция. С необходимата квалификация от лекар, шансът за благоприятен изход от операцията е деветдесет и осем процента. Смъртта на пациента се наблюдава само в два процента от случаите. След интервенцията интравентрикуларният градиент се елиминира при девет от десет пациенти. Повечето оцелели имат трайно подобрение в състоянието си.

С помощта на подмяна на митралната клапа е възможно да се елиминира запушването на изходящия тракт на LV.
Тази операция обаче е допустима само в случай на лека хипертрофия на преградата.
В допълнение, операцията е показана в случай на неефективна миоектомия и при наличие на структурни промени в митралната клапа.
Прогноза
Има много възможности за протичане на болестта. С необструктивна форма има стабилен потокболести. Но дори тази форма може да провокира развитието на сърдечна недостатъчност след продължителна прогресия на заболяването.
В някои случаи (при пет до десет процента от пациентите) със заболяването се наблюдава регресия на хипертрофия без използване на терапевтични мерки. Със същата честота болестта от хипертрофичната форма преминава. В някои случаи има усложнения, свързани с развитието на инфекциозен ендокардит.
В повечето случаи пациентите, които имат заболяването без клинични симптоми, умират внезапно. Подобна картина се наблюдава при пациенти с тежки симптоми. Най -вероятно е младите хора да умрат внезапно. Обикновено явлението се наблюдава след физически упражнения и натоварвания. Вентрикуларните аритмии са най -честата причина за този резултат.
Предпазни мерки
Тъй като болестта се задейства от генни мутации, няма начин да се спре нейното развитие. Превенцията е свързана с предотвратяване на внезапна смърт. На първо място е необходимо да се изследват всички роднини, които развиват проблема. Подобни действия ще дадат възможност да се идентифицира сърдечно заболяване преди преминаването му към клиничната фаза.
 В случай на откриване на генни мутации, лицето трябва да бъде постоянно под динамичния надзор на кардиолог.
В случай на откриване на генни мутации, лицето трябва да бъде постоянно под динамичния надзор на кардиолог.
Ако пациентът е изложен на риск от внезапна смърт, се предписват бета-блокери или лекарството "Cordaron". Въпреки че няма точни доказателства за ефекта на тези лекарства върху вероятността от смърт от болестта.
Независимо от формата на заболяването, на всеки пациент се препоръчва значително ограничаване на физическата активност. Подобна препоръка важи за тези, чието заболяване е безсимптомно. Ако има вероятност от развитие на ендокардит с инфекциозен характер, се предприемат подходящи превантивни мерки срещу това заболяване.
По този начин хипертрофичната кардиомиопатия се класифицира като наследствено заболяване. Патологията може да бъде безсимптомна. В някои случаи се наблюдава изразена клинична картина. Но често първият симптом на патологията е внезапна смърт (най -честата форма на смърт сред пациентите). След поставяне на диагнозата започва терапия.
Медикаментозното лечение на заболяването се състои в приемане на специални лекарства. Бета-блокерите са в основата на терапията за хипертрофична кардиомиопатия. В някои случаи, хирургическа интервенция... Вероятността от внезапна смърт при липса на лечение на болестта се увеличава. Но дори и при успешно лечение на болестта, съществува висок риск от развитие на усложнения, включително сърдечна недостатъчност и други сърдечни заболявания.
Миокардно заболяване, което често е генетично обусловено (мутация на гена, кодиращ един от протеините на сърдечния саркомер) и се характеризира с миокардна хипертрофия, главно на лявата камера, често с асиметрична хипертрофия на интервентрикуларната преграда и като правило , със запазена систолична функция. Според настоящата класификация генетично детерминираните синдроми и системни заболявания, при които се развива хипертрофия на миокарда, вкл. амилоидоза и гликогеноза.
КЛИНИЧНА СНИМКА И ТИПИЧЕН ТОК
1. Субективни симптоми: недостиг на въздух при натоварване (често срещан симптом), ортопнея, стенокардия, синкоп или пресинкопални състояния (особено под формата на стесняване на левокамерния изходящ тракт).
2. Обективни симптоми: систолично „котешко мъркане“ над върха на сърцето, дифузен апикален импулс, понякога - неговата бифуркация, III (само с левокамерна недостатъчност) или IV тон (главно при млади хора), ранно систолично щракване (показва значително стесняване на изходящия тракт на лявата камера), систоличен шум, обикновено crescendo -decrescendo, понякога - ускорен двуфазен периферен пулс.
3. Типичен ход: зависи от степента на миокардна хипертрофия, големината на градиента в изходящия тракт, склонността към аритмии (особено предсърдно мъждене и камерни аритмии). Често пациентите доживяват до старост, но също така и случаи на внезапна смърт в млада възраст (като първа проява на HCM) и сърдечна недостатъчност. Рискови фактори за внезапна смърт:
- 1) появата на внезапно спиране на кръвообращението или персистираща камерна тахикардия;
- 2) внезапна сърдечна смърт при роднина от 1 -ва степен;
- 3) скорошен необясним синкоп;
- 4) дебелина на стената на лявата камера ≥ 30 mm;
5) патологична реакция на кръвното налягане (повишаване<20 мм рт. Ст. Или снижение ≥ 20 мм рт. Ст.) Во время физической нагрузки, или эпизоды неустойчивой желудочковой тахикардии при холтеровском исследовании или электрокардиографическом тесте с физической нагрузкой, и наличие других дополнительных факторов. которые влияют на риск (значительного сужения выходного тракта левого желудочка, эффекта позднего усиления контрастирования при МРТ,>1 генна мутация).
Диагностика
спомагателни изследвания
1. ЕКГ: патологична Q вълна, особено в отводите от долната и страничните стени, ливограма, P вълна с неправилна форма (показва увеличение на лявото предсърдие или двете предсърдия), дълбока отрицателна T вълна в отводи V2-V4 (с езда форма на HCM) ...
2. RG на гръдния кош: може да открие уголемяване на лявата камера или на двете вентрикули и лявото предсърдие, особено при съпътстваща недостатъчност на митралната клапа.
3. Ехокардиография: значителна хипертрофия на миокарда, в повечето случаи генерализирана, обикновено с увреждане на интервентрикуларната преграда, както и предната и страничната стена. При някои пациенти се наблюдава хипертрофия само на базалните участъци на интервентрикуларната преграда, което води до стесняване на изходящия тракт на лявата камера, което в 25% от случаите е придружено от предно систолично движение на листовете на митралната клапа и неговата недостатъчност. В 1/4 от случаите има градиент между първоначалния тракт на лявата камера и аортата (градиент> 30 mm Hg. Има прогностична стойност). Прегледът се препоръчва за предварителна оценка на пациент със съмнение за HCM и като скринингово проучване при роднини на пациенти с HCM.
4. Електрокардиографски упражнителен тест: за оценка на риска от внезапна сърдечна смърт при пациенти с HCM.
7. 24-часов холтеров ЕКГ мониторинг: за идентифициране на възможни камерни тахикардии и оценка на показанията за имплантиране на МКБ.
8. Коронарна ангиография: при гръдна болка, за да се изключи съпътстващата коронарна болест.
диагностични критерии
Въз основа на откриване на миокардна хипертрофия по време на ехокардиографско изследване и изключване на други причини, предимно артериална хипертония и стеноза на аортната клапа.
диференциална диагноза
Артериална хипертония (в случай на HCM със симетрична хипертрофия на лявата камера), липса на аортна клапа (особено стеноза), предишен инфаркт на миокарда, болест на Фабри, пресен миокарден инфаркт (с повишена концентрациясърдечни тропонини).
Фармакологично лечение
1. Пациенти без субективни симптоми: наблюдение.
2. Пациенти със субективни симптоми: β-блокери (например бисопролол 5-10 mg / ден, метопролол 100-200 mg / ден, пропранолол до 480 mg / ден, особено при пациенти с градиент в левия вентрикуларен изходящ тракт след тренировка); увеличавайте дозата постепенно, в зависимост от ефективността и поносимостта на лекарствата (изисква постоянно наблюдение на кръвното налягане, пулса и ЕКГ); в случай на неефективност → верапамил 120-480 mg / ден или дилтиазем 180-360 mg / ден, внимателно при пациенти със стеснение на изходящия тракт (при тези пациенти не използвайте нифедипин, нитроглицерин, дигиталисови гликозиди и АСЕ инхибитори).
3. Пациенти със сърдечна недостатъчност фармакологично лечение както при DCM.
4. Предсърдно мъждене: опитайте се да възстановите и поддържате синусовия ритъм с амиодарон (показан също за камерни аритмии) или соталол. Антикоагулантната терапия е показана при пациенти с персистиращо предсърдно мъждене.
инвазивно лечение
1. Хирургична резекция, стесняваща левия вентрикуларен изходящ тракт на част от интервентрикуларната преграда (миектомия, операция на Мороу): при пациенти с мигновен градиент в изходящия тракт> 50 mm Hg. Изкуство. (в покой или по време на тренировка) и тежки симптоми, ограничаващи активността, обикновено недостиг на въздух при усилие и болка в гърдите, които не реагират на фармакологично лечение.
2. Перкутанна алкохолна аблация на преградата: въвеждане на чист алкохол в перфориращия септален клон с цел развитие на инфаркт на миокарда в проксималната част на интервентрикуларната преграда; показанията са същите като при миектомия; ефективността е подобна на тази хирургично лечение... Не се препоръчва за пациенти в напреднала възраст<40 г. которым можно выполнить миектомию.
3. Двукамерна пейсинг: за да се даде възможност за засилване на фармакологичното лечение; помислете за показания при пациенти, които не могат да бъдат лекувани с миектомия или алкохолна аблация; не се препоръчва за тежка HCM със стеснен изходящ тракт на лявата камера.
4. Сърдечна трансплантация. при терминална сърдечна недостатъчност, не се повлиява от лечението.
5. Имплантиране на кардиовертер-дефибрилатор: при пациенти със значителен риск от внезапна смърт (първична профилактика), както и при пациенти след сърдечен арест или с персистираща, спонтанно възникнала камерна тахикардия (вторична профилактика).
При пациенти с висок риск от смърт ежегодно провеждайте електрокардиографски тест за упражнения и холтеров ЕКГ мониторинг; при пациенти с незначителен риск - на всеки 3-5 години. Ако се открие патогенна мутация при лице без симптоми на заболяването, периодични последващи прегледи (включително ЕКГ и трансторакална ехокардиография) на всеки 5 години при възрастни и на всеки 12-18 месеца. при деца.
Най -интересната новина
Хипертрофична кардиомиопатия. Диагностика и лечение на хипертрофична кардиомиопатия.
Характеризира се с лява и / или дясна вентрикуларна хипертрофия с дифузно или сегментарно удебеляване на стените им и междукамерната преграда. В този случай кухината на лявата камера е нормална или намалена. Това състояние може да бъде придружено от нарушение на систоличната или диастоличната функция на вентрикулите.
Асиметрични хипертрофия на интервентрикуларната преградасе среща при 70% от пациентите, концентрична хипертрофия на лявата камера - при 30%. При последната форма дясната камера често участва в процеса (-75%); почти една трета от децата имат синдром на Noonan.
Хипертрофична кардиомиопатиямогат да бъдат представени под формата на необструктивна или обструктивна (40%) форма, която се определя от наличието на градиент в изходящия тракт на лявата камера над 15 mm Hg. Изкуство. Обструктивната форма на HCM има по -лоша прогноза, тъй като води до повишено натоварване на вентрикуларната стена, миокардна исхемия, клетъчна смърт и заместването им от фиброзна тъкан.
Интравентрикуларната констрикция може да бъде локализирана директно в субаорталната или в средната част на лявата камера. По правило препятствието не е фиксирано, а динамично. В по -голяма възраст се открива с помощта на провокативни тестове (с физическа активност, с инотропни лекарства). В субаорталния участък стеснението се образува поради предния връх на митралната клапа, която под действието на мощен поток от кръв в систолата прави предно движение и влиза в контакт с хипертрофираната междукамерна преграда. Това явление, в допълнение към запушването на изхода, води до непълно затваряне на крилата на митралната клапа и до регургитация главно в задната част на лявото предсърдие. Когато потокът на регургитация е насочен отпред или централно, е възможно да се предположи независимо поражение на митралната клапа (миксоматозна дегенерация, фиброза и др.). В около 5% от случаите стеснението, разположено в средната част на вентрикула, е свързано с хипертрофия и анормална локализация на папиларните мускули. В тези случаи не се открива митрална регургитация.
Предвид факта че хипертрофична кардиомиопатияв значителна част от случаите той е от семеен характер и се предава по автозомно -доминантни начини; когато се идентифицира пациент с тази патология, е необходимо изследване на близките.
Клинични симптоми на хипертрофична кардиомиопатия.
Основи за изследване на плодаса подобни на тези при дилатационна кардиомиопатия. HCM по време на фетална ехокардиография се диагностицира, ако дебелината на вентрикуларната стена надвишава две стандартни отклонения за дадена гестационна възраст (виж Приложение 1). Систолична и диастолична дисфункция и атриовентрикуларна клапна регургитация се откриват при 30-50% от фетусите.
След раждането симптоматикаможе да е оскъден. При аускултация при половината от децата се определя систоличен шум с различна интензивност. Възможни са нарушения на ритъма, главно - суправентрикуларна тахикардия. Ако сърдечната дисфункция се прояви дори вътреутробно, основните симптоми при новородените ще бъдат задух, тахикардия и задържане на течности. При бивентрикуларна обструкция не е изключена цианоза и бързо прогресиране на заболяването.
Като цяло проявлението патологияпо време на неонаталния период показва неговата тежест и е придружен от лоша прогноза. Общата смъртност, включително пренаталния период, е повече от 50%.
Електрокардиография... По правило през неонаталния период промените в ЕКГ са минимални. Възможни са признаци на хипертрофия на лявата и дясната камера, неспецифични нарушения на процесите на реполяризация.
Рентгенография на гръдния кош... Сенката на сърцето и белодробният модел се променят с развитието на застойна сърдечна недостатъчност. При негово отсъствие може да няма патологични промени.
Ехокардиография... Изследването най -често разкрива асиметрична хипертрофия на интервентрикуларната преграда, а при около една трета от пациентите - концентрична хипертрофия на лявата камера. Освен това можете да установите предното систолично движение на митралната листовка, наличието на средна вентрикуларна обструкция, митрална регургитация.
В повечето случаи (около 80%) се определя вентрикуларна диастолична дисфункция - намаляване на пика на VE и увеличаване на пика на VA.
Лечение на хипертрофична кардиомиопатия.
Основните лекарства, използвани за лечение на хипертрофична кардиомиопатияпри възрастни, са β-блокери, дизопирамид, блокери на калциевите канали, които имат отрицателен инотропен ефект. Резултатът от тяхното използване също е намаляване на сърдечната честота, удължаване на диастолата и подобряване на условията за пасивно запълване на вентрикулите. Ефектът на тези лекарства при новородени обаче не е добре разбран. Известно е например, че верапамил повишава налягането в белодробната артерия и интравенозното му приложение при кърмачета може да доведе до внезапна смърт. Четвъртото поколение р-блокери изглежда са по-обещаващи. Случаите на употребата им при кърмачета са малко, но в по -голяма възраст те са доста ефективни. Освен това можете да използвате лекарства, които подобряват енергийния метаболизъм на клетките.
Трябва да се препоръчва предпазливост срещу употреба вазодилататори... инхибитори на АСЕ синтеза или дигоксин при лечението на HCM, тъй като тези лекарства могат да провокират камерна обструкция.
Хирургическа интервенция с хипертрофична кардиомиопатиясе състои в резекция или дисекция на хипертрофираната интервентрикуларна преграда и се извършва в по -напреднала възраст.
Хипертрофична кардиомиопатия - симптоми, диагностика и лечение

Хипертрофичната кардиомиопатия е вродено или придобито заболяване, характеризиращо се с тежка хипертрофия на вентрикуларния миокард с диастолична дисфункция и сърдечни аритмии.
Причини за хипертрофична кардиомиопатия
Заболяването може да се развие в резултат на предразположение към него, високо кръвно налягане и физиологично стареене на организма.
Симптоми на хипертрофична кардиомиопатия
Хипертрофичната кардиомиопатия при много хора е асимптоматична или минимална, но някои могат да показват признаци на заболяването и прогреса.
При хипертрофична кардиомиопатия се наблюдават следните симптоми:
високо кръвно налягане и болка в гърдите, които се появяват след хранене или упражнения;
- диспнея;
- бърза умора;
- кардиопалмус;
- припадък.
Смъртта настъпва при малка част от пациентите.
Диагностика на хипертрофична кардиомиопатия
Хипертрофичната кардиомиопатия се диагностицира въз основа на анамнеза (оплаквания на пациенти, като се отчита влиянието на наследствеността), резултатите от екокардиограмата и физиологичните изследвания. Възможно е също така да се проведат допълнителни изследвания, които включват рентгенография на гръдния кош, ЕКГ, кръвен тест, ядрено-магнитен резонанс, компютърна томография, сърдечна катетеризация, тест за упражнения.
Лечение на хипертрофична кардиомиопатия
При лечението на това заболяване се коригират основните симптоми и се предотвратяват животозастрашаващи усложнения. На пациентите се предписват лекарства, които отпускат сърцето и подобряват кръвообращението. Има два класа лекарства, които се считат за традиционни лекарства - блокери на калциевите канали и бета -блокери. За лечение на аритмия се използват лекарства, които намаляват проявите й и контролират сърдечната честота.
Признаците на хипертрофична кардиомиопатия без симптоми на запушване се лекуват с лекарства. Лечението на сърдечна недостатъчност се състои в контролирането му със специални лекарства.
В случай на неефективност на консервативното лечение е показана хирургична интервенция. За хипертрофична кардиомиопатия се използват следните хирургични процедури: етанолна аблация, септална миектомия или имплантиране на електрически дефибрилатор.
При хипертрофична кардиомиопатия се препоръчват и промени в начина на живот.
Следвайте диетата, предписана от Вашия лекар. Ако няма ограничения за пиене, трябва да пиете шест до осем чаши вода на ден, по време на топлината, увеличете приема на течности. Пациентите със сърдечна недостатъчност трябва да ограничат приема на готварска сол и течности. Консултирайте се с лекар за храни с кофеин и алкохолни напитки.
Що се отнася до физическата активност, този въпрос трябва да бъде обсъден с лекуващия лекар. Леката аеробика обикновено не е противопоказана при хора с кардиомиопатия, но вдигането на тежести не се препоръчва.
Пациентите с хипертрофична кардиомиопатия трябва да посещават кардиолог ежегодно. Ако заболяването е открито наскоро, честотата на посещенията може да се увеличи.
Риск от внезапна смърт
Сред пациентите с хипертрофична кардиомиопатия само малка част имат повишен риск от внезапна смърт. Тази група включва хора с лоша наследственост; аритмия с висока сърдечна честота; силно увеличаване на налягането по време на физическо натоварване; с повтарящи се случаи на припадък; лоша сърдечна функция и тежки симптоми на заболяването.
Ако има два или повече признака, трябва спешно да се консултирате с лекар.
Хипертрофичната кардиомиопатия (HCM) е наследствено миокардно заболяване с масивна хипертрофия на камерните стени (главно LV). Тежката хипертрофия на LV (както и общата асиметрична хипертрофия на IVS) е придружена от намаляване на размера на кухината на LV, диастолична дисфункция и често запушване на изходящия тракт на LV (субаортална стеноза).
HCM е честа причина за внезапна аритмична смърт. Целта на фармакотерапията е да се подобри толерантността към упражненията, да се предотврати ХСН, да се намали обструкцията, да се подобри LV диастоличното пълнене (калциеви антагонисти, бета-блокери) и да се предотвратят вентрикуларни тахиаритмии (амиодарон, бета-блокери). Хирургичните интервенции (миотомия, миоектомия, алкохолна аблация на IVS) могат да намалят степента на обструкция в изходящия тракт на лявата камера и да премахнат митралната регургитация.
Ключови думи: хипертрофия на лявата камера, фамилна генетична хипертрофия на лявата камера, асиметрична интервентрикуларна хипертрофия на преградата.
ВЪВЕДЕНИЕ
Хипертрофичната кардиомиопатия (HCM) е наследствено миокардно заболяване с масивна хипертрофия на стените на вентрикулите (главно отляво) (фиг. 2.1, вижте вложката), водещо до намаляване на размера на кухината на лявата камера ( LV), нарушение на неговата диастолична функция и често затруднява изхода на LV при пациенти без други заболявания, водещи до развитие на хипертрофия (артериална хипертония, ХОББ, сърдечни дефекти и др.).
Истинската честота и разпространение на HCM не са точно установени. Съгласно съвместно споразумение между Американския колеж по кардиология и Европейското дружество по кардиология, HCM е относително често срещана патология (1: 500 при общото възрастно население). Широкото използване на ехокардиография (ехокардиография) направи възможно да се твърди, че заболяването е по -често срещано, отколкото се смяташе досега, и има по -добра прогноза, отколкото се смяташе досега. Според някои автори при 0,2% от практически здравите млади хора се откриват ехокардиографски признаци на HCM. Установен е автозомно доминиращ тип наследяване и в повече от 50% от случаите подобна патология може да бъде идентифицирана сред роднините на пациентите. Заболяването се среща почти еднакво при мъже и жени, както и при представители на различни националности.
HCM е честа причина за внезапна смърт (SCD) при млади хора (включително тренирани спортисти) и може да доведе до смърт или увреждане при хора от всички възрасти. Според отделните центрове годишната смъртност на такива пациенти от VS е 1-2% при възрастни и 4-6% при деца. Въпреки това, дори дълъг ход на заболяването може да бъде придружен от нормално здравословно състояние и да не променя продължителността на живота. Поради хетерогенността на клиничната картина, HCM може да остане недиагностициран за дълго време. Освен това, като се има предвид относително ниската честота на това заболяване в рутинната практика на кардиолог, досега не са проучени всички механизми на неговото развитие и нивото на доказателства за използването на определени методи на терапия остава ниско.
При диагностицирането на HCM е от голямо значение да се открие идиопатична хипертрофия на LV с помощта на ехокардиография и ЕКГ, както и да се идентифицира запушване на изходящия тракт на LV.
Целта на фармакотерапията е да се подобри толерантността към упражненията, да се предотврати ХСН, да се намали обструкцията чрез подобряване на LV диастоличното пълнене (калциеви антагонисти, бета-блокери) и предотвратяване на камерни тахиаритмии (бета-блокери, амиодарон). Хирургическата интервенция може да намали степента на запушване в изходящия тракт на LV и да премахне митралната регургитация.
КЛАСИФИКАЦИЯ
Понастоящем терминът хипертрофична кардиомиопатия е добре установен. Варианти на имена като хипертрофична обструктивна кардиомиопатия, мускулна субаортна стеноза или идиопатична хипертрофична субаортна стеноза са ограничени в употребата, тъй като някои пациенти, особено в покой, нямат обструкция на изходящия тракт на LV.
Недостатъкът на тази класификация обаче е, че тя не взема предвид наличието или отсъствието на запушване на изхода на НН. Съвременната класификация на заболяването се основава на локализацията на хипертрофирани области на миокарда и възникващите хемодинамични нарушения:
Идиопатична хипертрофична субаортна стеноза;
Асиметрична септална хипертрофия без промени в аортната и митралната клапа и без запушване на изходящия тракт на LV;
Апикална HCM с ограничаване на зоната на хипертрофия до областта на върха;
Симетричен HCM с концентрична LV миокардна хипертрофия.
Последните 3 форми са изключително редки и не са придружени от развитието на обструкция на изходящия тракт на ЛК.
ГЕНЕТИКА И МОРФОЛОГИЯ
Както вече споменахме, болестта се предава по автозомно доминантно. Той се основава на мутация в един от 10 гени, кодиращи саркомерни протеини в миокарда. В резултат на това в кардиомиоцитите се откриват анормални контрактилни протеини, което прави възможно разглеждането на HCM като „саркомерна болест“. Синтезът на анормални протеини се определя от хромозомни точкови мутации. Протеините, чиято патология определя развитието на HCM, понастоящем включват:
Тежка верига от сърдечен бета-миозин (14-та хромозома);
Сърдечен тропонин Т (1 -ва хромозома);
Свързан с миозин протеин С (хромозома 11);
Тропомиозин (хромозома 15);
Миозин с лека верига; титин;
Алфа актин;
Сърдечен тропонин I;
Тежка верига от сърдечен алфа-миозин.
Общо са идентифицирани повече от 100 различни мутации, свързани с HCM: в 10 гена, кодиращи саркомерни протеини, мутации в 2 гена, кодиращи несаркомерни протеини и една мутация в митохондриалната ДНК. Най-често има мутантни гени, кодиращи синтеза на тежката верига от сърдечен миозин, сърдечен тропонин Т и миозин-асоцииран протеин С. Молекулните дефекти, отговорни за развитието на HCM при несвързани пациенти, най-често са различни.
Мутациите на тропонин Т са свързани с повишена консумация на енергия, която предразполага към исхемия и аритмии. Някои автори свързват тропонин Т мутации с увеличаване на честотата на VS. Няколко мутации на миозин в тежка верига също са свързани с повишен риск от аритмии и смъртност. Все още обаче не е известно до каква степен специфичните нарушения на йонния поток са отговорни за електрофизиологичните нарушения и каква роля играе широко разпространената фиброза. Предполага се, че HCM има генетично определен дефект в апарата на адренергичните рецептори или аномалия на трансмембранния транспорт на калциеви йони с увеличаване на навлизането му в клетката и сенсибилизация на миокарда към действието на катехоламините.
Очевидно не всички хора, носещи генетична мутация, развиват фенотипни признаци на HCM. Има гледна точка, че фенотипните прояви на заболяването се променят от модифициращите гени. Например, функционалните варианти на ангиотензин-1 конвертиращия ензимен ген могат да повлияят на HCM фенотипа и са свързани с риска от VS. Интересното е, че клиниката за диастолична дисфункция може да бъде открита по -рано от ехокардиографските признаци на заболяването.
Предполага се, че фенотипът на заболяването се формира с растежа и формирането на организма, а морфологичните прояви се откриват при достигане на 17-18 годишна възраст. Липсата на признаци на заболяването в млада и дори средна възраст при наличие на фамилна анамнеза за заболяването не може да гарантира липсата на HCM при пациента.
Препоръчва се скрининг на роднини от първа линия. В същото време, ако е невъзможно да се извърши генетичен анализ, се препоръчва годишен преглед, включващ клиничен преглед, 12-оловна ЕКГ, ЕхоКГ до 18-годишна възраст. Освен това се препоръчва провеждането на проучвания на всеки пет години.
Скринингът при деца на възраст под 12 години не е препоръчителен, освен в случаите на висок семеен риск и планирани сериозни спортни дейности.
Микроскопичните промени в миокарда при HCM се характеризират с хипертрофия на мускулните влакна и нарушаване на тяхната взаимна ориентация, влакната са произволно разположени под ъгъл един към друг, пресичат се или образуват вихри (фиг. 2.2). Бяха
Ориз. 2.2.Местоположение на миоцитите в норма (а) и при пациенти с HCM (б)
са установени значителни нарушения в разпределението на междуклетъчните връзки в области с нарушена структура на миофибрил - връзките са разположени по цялата повърхност на клетката, докато обикновено те са концентрирани в добре очертани интеркалирани дискове.
Такова неправилно подреждане на влакната създава морфологичен субстрат за възникване на циркулация и повторно навлизане на вълната на възбуждане (повторно влизане), предопределяйки появата на пароксизмални ритъмни смущения.
Хипертрофията на миокардните влакна е придружена от натрупвания на митохондрии и гликоген, както и перинуклеарни клирънси на цитоплазмата ("нимб"). Наблюдаваните дегенеративни промени, понякога удебеляване на ендокарда и интерстициална фиброза са вторични. В някои случаи на ендокарда на удебелената част на интервентрикуларната преграда се откриват плоски влакнести плаки, които се образуват на мястото на многократни контакти с предната част на митралната клапа.
Значителни нарушения на нормалната взаимна ориентация на мускулните влакна и фиброзит на ендокарда на интервентрикуларната преграда се считат за характерни за HCM. Останалите микроскопични промени са неспецифични и могат да бъдат открити с миокардна хипертрофия от всякакъв произход. Епикардиалните коронарни артерии в HCM не се променят.
HCM се основава на мутация в един от 10 гена, кодиращи саркомерни протеини в миокарда.
СЪРЦЕВА ГЕОМЕТРИЯ И ХАРАКТЕРИСТИКИ
ХЕМОДИНАМИКА
Миокардната хипертрофия при HCM често е най -силно изразена в областта на интервентрикуларната преграда (IVS), тоест тя е асиметрична и е придружена от дезорганизация на миоцитите и миофибрилите (фиг. 2.3). В допълнение, заболяването е свързано с развитието на миокардна фиброза и увреждане на малки съдове.
Последицата от промените в геометрията на LV и морфологията на миокарда в HCM е преди всичко нарушение на диастоличното запълване на LV, което води до диспнея и други прояви на сърдечна недостатъчност, което е една от причините от смъртта на пациентите. Характерен е и синкопът, свързан с развитието на камерни тахиаритмии. Последните са честа причина за VS при пациенти с HCM.
В 20% от случаите се образува динамичен градиент в изходящия тракт на LV, поради комбинация от увеличени скорости на потока и стесняване на изходящия участък поради предното систолично движение на митралната клапа (PSVM).
Външно сърцето е леко променено. Има хипертрофия на ЛК без разширяване на кухината му; в същото време лявото предсърдие може да бъде разширено, което показва нарушение на диастоличното запълване на вентрикула.
Наклон в изхода на LV (LVOT) води до силен систоличен шум. Освен това се разкрива хипертрофия на базалната част на IVS и тесен изходящ тракт, както и при много пациенти удебелени и удължени листчета на митралната клапа.
Обструкция на изходящия тракт на лявата камера (LVOT).Както следва от класификацията, не всички пациенти с HCM имат стеснение в изходящия тракт от LV. Освен това при повечето пациенти в покой няма градиент в LVOT. Разделянето на пациентите на групи със и без обструкция на изтичането на LV е клинично критично. Това се дължи на факта, че почти всички лекарствени и хирургични стратегии за HCM терапия са насочени предимно към пациенти с признаци на LVOT обструкция. Изборът на лекарства и методи за хирургична корекция се определя от хемодинамичния статус на пациента.
Subaortic steno h е следствие от предното систолично движение на предната клапа на MC (PSDMK) и произтичащото от това
нейният среден систоличен контакт с IVS. Повишената контрактилност на LV в комбинация с леко стесняване на изходящия тракт от субаорталната мускулна ролка води до ускорено изхвърляне на кръв в аортата. Увеличаването на линейната скорост на кръвния поток причинява ефекта на Вентури - "засмукващо" действие на флуиден поток, движещ се с висока скорост, който издърпва предния митрален клапан в изходящия тракт на LV, което води до неговото значително стесняване и появата на градиент на налягане. В някои случаи има докосване на предната част на митралната клапа (SCV) към миокарда на IVS. По този начин обструкцията възниква само през втората половина на периода на изгонване, а тежестта й се увеличава с увеличаване на контрактилитета на миокарда на LV (фиг. 2.3).
 Ориз. 2.3. EchoCG на пациент с HCM в М-режим; видимо е антеропосистолично движение на апарата на митралната клапа (маркирано със стрелка)
Ориз. 2.3. EchoCG на пациент с HCM в М-режим; видимо е антеропосистолично движение на апарата на митралната клапа (маркирано със стрелка)
Антеро-систоличното движение на МС води не само до запушване на лявата камера, но и до появата на митрална регургитация (МР) с различна тежест. В този случай е характерна посоката на потока на регургитация към задната стена на LV. Потокът на регургитация, насочен централно и към предната стена на предсърдието, както и наличието на няколко потока, изискват изключване на независима патология на митралната клапа.
В около 5% от случаите наличието на градиент и намалено изхвърляне се причинява главно от хипертрофия на миокарда в централната
част от кухината на LV и промени в предния страничен папиларен мускул при липса на контакт между PSMK и IVS.
Субаорталният градиент (повече от 30 mm Hg и повече) и свързаното с него повишаване на интравентрикуларното налягане са изключително важни както от гледна точка на патофизиологията на заболяването, така и от гледна точка на прогнозата на пациентите. Обструкцията на LVOTO е независим предиктор за смърт поради HCM, тежка сърдечна недостатъчност (NYHA клас III-IV) и смърт от сърдечна недостатъчност и инсулт. В същото време се увеличава градиентът с повече от 30 mm Hg. според изследователите тя не е придружена от допълнително увеличаване на риска.
Сега е общоприето, че обструкцията при HCM е динамична. Препоръчва се всички пациенти с HCM да се разделят на "хемодинамични подгрупи" според нивото на пиковия градиент в LVOT, променен чрез доплер с непрекъсната вълна:
1. Градиентът в покой е равен или по -голям от 30 mm Hg. (2,7 m / s, според доплерова сонография);
2. Латентен градиент - в покой по -малко от 30 mm Hg. и се увеличава до 30 или повече по време на провокативни тестове;
3. Необструктивна кардиомиопатия - градиент под 30 mm Hg. в покой и с провокация.
Предложени са редица провокативни тестове за симулиране на натоварването по време на ехокардиография (както и по време на сърдечна катетеризация). Включително това са тестове за наркотици с амилнитрит, изопротеренол, добутамин, както и механични тестове - маневрата на Валсалва, ортостаза и физическа активност. Най -физиологичният и често срещан е тестът за бягаща пътека или велоергометрията паралелно с доплер ехокардиография.
В допълнение към обструктивните разстройства, интракардиалната хемодинамика при HCM има следните характеристики:
1. Високи показатели на систоличната функция (малък краен диастоличен обем, висока EF и скорост на изтласкване), поради повишена контрактилност на хипертрофирания миокард;
2. Нарушаване на диастоличната функция поради повишена скованост на хипертрофирания миокард, което нарушава диастоличната му релаксация и затруднява запълването на кухината на камерата с кръв по време на диастола;
3. Често присъствие на MR, основните причини за което са:
Изместване на предния папиларен мускул по -близо до митралната клапа, което се случва, когато размерът на кухината намалява
Влакнести промени в предния митрален лист, произтичащи от хемодинамичното му увреждане от ускорен турбулентен поток в изходящия тракт или контакт с IVS;
Вторични лезии на митралната клапа (калцификация, бактериален ендокардит), водещи до нейната дисфункция.
Последицата от промените в геометрията на миокарда на LV в HCM е нарушение на диастолното пълнене на LV, както и синкоп, свързан с камерни тахиаритмии. Поради антеро-систоличното движение на предния лист на митралната клапа и контакта му с IVS, може да се създаде динамичен градиент в изходящия тракт на LV.
КЛИНИКА
Клиничната картина на HCM е много променлива - от асимптоматични форми до тежки клинични прояви или внезапна смърт. Диагнозата се улеснява от наличието на фамилна анамнеза за случаи на HCM или VS. При липса на оплаквания, първата проява на заболяването обикновено е откриването на систоличен шум или промени в ЕКГ (признаци на хипертрофия на ЛК). Първите оплаквания обикновено се появяват на възраст 20-25 години.
Типичната клинична картина на HCM е представена от триада:
Ангина пекторис;
Аритмии;
Условия на синкоп.
Типична комбинация от тези симптоми е систоличен шум, промени в ЕКГ и индикации за случаи на HCM или VS сред роднини.
Болка в гърдите с HCMчесто имат типичен ангинален характер поради миокардна исхемия. Те представляват класически пример за ангина синдром, който не е свързан с оклузия на коронарната артерия. По -рядко се срещат атипични болки. Миокардната исхемия при HCM е свързана с относителна коронарна недостатъчност. Тъй като резервите за увеличаване на коронарното кръвоснабдяване не са неограничени, възниква разминаване между максимума
но възможен коронарен кръвен поток и повишено търсене на хипертрофиран миокард в артериалната кръв. Въпреки това, при лица от по -възрастни възрастови групи, за да се изключи уверено комбинация с ИБС, е необходимо да се извърши коронарна ангиография.
Характерен симптом на HCM е синкоп и пресинкопални състояния, при които се появяват тежка слабост, замаяност и потъмняване на очите. Те могат да бъдат причинени от намаляване на сърдечния дебит и недостатъчно кръвоснабдяване на мозъка в резултат на запушване на изходящия тракт на LV или епизоди на тахиаритмии.
Аритмичен синдромзаема важно място в клиничната картина на HCM и до голяма степен определя прогнозата на заболяването. Общоприето е, че субстратът за развитието на аритмии е комбинация от хипертрофия, нарушаване на структурата на миоцитите, фиброза и анормално разпределение на разкъсани междуклетъчни връзки (конексони). Предполага се, че анизотропията се променя в области с нарушена структура на миофибрил, възниква анормална импулсна проводимост, което може да доведе до развитие на повторно навлизане.
Пациентите се оплакват от внезапни сърдечни удари с различна продължителност, въпреки че кратките епизоди могат да бъдат безсимптомни. Следователно, за откриване на ритъмни нарушения, холтеровото ЕКГ наблюдение е показано за всички пациенти с HCM.
Спектърът на откритите аритмии е изключително широк. Повечето от тях са камерни аритмии от различна степен-от единични екстрасистоли и кратки периоди на камерна тахикардия с 3-5 контракции, невинаги усещани от пациентите, до животозастрашаващи пароксизми на двупосочна тахикардия с възможност за камерна фибрилация и внезапна смърт. Отбелязват се и пароксизми на суправентрикуларна тахикардия и предсърдно мъждене или трептене. Появата на постоянна форма на предсърдно мъждене е прогностично неблагоприятен знак, често предхождащ развитието на застойна NK и е рисков фактор за емболични усложнения. Често се отбелязва синдром на WPW.
Сърдечна недостатъчност.Диастолната дисфункция на LV е една от основните хемодинамични прояви на заболяването и понякога се появява дори преди да бъдат открити типични промени в ехокардиографията. При HCM може да се появи инспираторна диспнея
един от най -ранните симптоми. Появата му е свързана с нарушение на диастоличното запълване на LV, в резултат на което настъпва застой в белодробната циркулация. Хепатомегалия и други задръствания в системното кръвообращение са редки, главно в крайния стадий на заболяването.
Данни за външен преглед в HCMPоскъден. Пациентите обикновено имат правилното телосложение и добре развити мускули, липсват бледност и цианоза. Увеличаването на размера на сърцето не винаги може да бъде открито. Апикалният импулс се засилва, понякога се измества наляво. При обструктивна HCM може да има характерни физически симптоми:
периодичен резки пулс;
Палпира се в прекордиалната област, увеличени контракции на лявото предсърдие;
Систоличен шум.
Систоличен шум се чува на върха и в III или IV междуребреното пространство по левия ръб на гръдната кост. Шумът има духащ характер, може да се пренесе в аксиларната област. Шумът е малко отдалечен от I тона.
Функционалните и фармакологичните тестове са от голямо значение за интерпретацията на аускултативната картина. Интензивността на систоличния шум директно зависи от големината на градиента на налягането в изходящия тракт от камерата. Следователно, всички влияния, които намаляват предварителното натоварване и диастоличното запълване на LV, водят до увеличаване на контрактилитета на миокарда, предизвикват увеличаване на степента на запушване и съответно увеличаване на шума и по -ранния му вид. Такива промени възникват по време на прехода към ортостаза, тест на Valsalva, приемане на вазодилататори (нитроглицерин), по време на тахикардия. Упражненията, приемът на дигоксин или изадрин също увеличават контрактилитета на миокарда на ЛК и водят до повишен шум.
Обратните последици са преминаването в хоризонтално положение, клякането и приемането на бета-блокери. С тези тестове брадикардията и увеличеното венозно връщане към сърцето увеличават запълването на LV в диастолата, което намалява скоростта на потока в систолата и интензивността на систоличния шум.
Характерната клинична картина на HCM е представена от триада: ангина пекторис, аритмии, синкоп.
Ангината, като правило, не е свързана с наличието на стенозиращи плаки в коронарните артерии, но това не може да се изключи при по -възрастните възрастови групи.
Курс и прогноза.Прогнозата за HCM се счита за неблагоприятна, смъртността е до 5% годишно. Повече от половината от смъртните случаи, главно сред младите пациенти, са случаи на VS. Рискът от аритмогенна VS се увеличава особено по време на физическа активност или спорт.
Прогностично неблагоприятните фактори са:
голяма маса на миокарда на LV;
Вентрикуларни аритмии от висок клас според Lown;
Условия на синкоп;
Слънчеви случаи сред роднини.
Сред по -възрастните пациенти с HCM (над 40 години) причината за смъртта е по -често застойна NK и добавяне на инфекциозен ендокадит.
Важни фактори, които определят прогнозата и избора на терапия, са:
1. Висок риск от слънце (като се вземат предвид данните от анамнезата);
2. Прогресиране на симптоми като гръдна болка, задух и нарушено съзнание (синкоп, пресинкопи, замаяност) със запазена систолична функция на LV;
3. Прогресия на сърдечна недостатъчност с развитието на LM ремоделиране и систолична дисфункция;
4. Усложнения, свързани с развитието на предсърдно мъждене, включително емболичен инсулт.
Трябва да се помни, че HCM често се комбинира с други сърдечни заболявания, като артериална хипертония и коронарна артериална болест, които могат да повлияят на избора на терапия.
Прогнозата за HCM е сравнително лоша. Повече от половината от смъртните случаи са внезапни поради камерни тахиаритмии, рискът от които се увеличава с физическа активност, особено спортна активност.
ИНСТРУМЕНТАЛНА ДИАГНОСТИКА
ЕКГ.При пациенти с HCM на ЕКГ обикновено има картина на LV миокардна хипертрофия с асиметрично обърната
зъбци Tи косо низходяща депресия на сегмента СВ(фиг. 2.4). Тежката хипертрофия на IVS води до появата на патологични зъби Q,което може да доведе до погрешна диагноза на ОМИ. Патологични зъби Вс HCM, обикновено дълбоки, но не разширени и заострени, записани в изводи II, III, avF, в левите гърди, понякога в изводи V3-V4. В същото време амплитудата на зъбите може да намалее Rв изводи V2-V4. Признаците на предсърдна хипертрофия често се записват под формата на уголемяване и разцепване на зъбите PI, II.
 Ориз. 2.4.ЕКГ на пациент с HCM. Признаци на хипертрофия на ЛК
Ориз. 2.4.ЕКГ на пациент с HCM. Признаци на хипертрофия на ЛК
При апикалната форма на HCM единствената му проява може да бъде ЕКГ промени под формата на картина на хипертрофия на миокарда на LV с гигантски отрицателни Т вълни в гръдните канали, чиято дълбочина може да надвишава 10-15 mm.
Рентгенография на гръдния кошс HCM не е много информативен. Сенката на сърцето не се променя или показва увеличение на лявата камера (фиг. 2.5). Може да се открие разширение на възходящата аорта. Кардиомегалията се открива рядко и при HCM може да бъде причинена от хипертрофия на миокарда без дилатация на кухината на LV.
По-рядко срещаните рентгенови симптоми включват:
Умерено увеличение на лявото предсърдие (особено при наличие на митрална регургитация);
Леко изразен застой в белодробната циркулация;
Калцификация на фиброзния пръстен на митралната клапа (което може да доведе до погрешна диагноза на ревматично сърдечно заболяване).
С ангиокардиографияразкрива намаляване на кухината на LV и нейната деформация под формата на „пясъчен часовник“ по време на систола, но необходимостта от това изследване обикновено възниква само при подготовката за хирургично лечение. В същото време по време на сърдечна катетеризация се определят градиенти на налягане по изходящия тракт от LV.
Ехокардиографияе най-ценното и информативно неинвазивно изследване в HCM.
Класическите ехокардиографски признаци на HCM са:
1. Асиметрично удебеляване на IVS, при което съотношението на дебелината на преградата към дебелината на противоположната част на задната стена на LV е 1,3 или повече (до 2,5-3,0) (фиг. 2.5);
2. IVS хипокинезия (амплитудата на изместването му по време на сърдечната контракция е по -малка от 3 mm);
3. Намаляване на кухината на LV, особено изразено по време на систола. Поради мощното мускулно свиване на хипертрофирания миокард, стените на вентрикула могат да се затворят, при което има пълно изчезване (елиминиране) на кухината му;
4. Значително увеличаване на контрактилитета на ЛК, сред които повишението на ЕФ е особено изразено;
5. Разширяване на лявата предсърдна кухина.
При наличие на градиент на налягане в изходящия тракт на LV, допълнително се отбелязват следните явления:
 Ориз. 2.5.Рентгенова снимка на пациент с HCM
Ориз. 2.5.Рентгенова снимка на пациент с HCM
1. Предно систолично движение на митралната клапа - изместване по време на систола на предната митрална клапа напред и приближаването й до IVS - до докосване (фиг. 2.6, виж вмъкването);
2. Систолично затваряне на аортната клапа - известно сближаване на аортните върхове в средата на систолата поради намаляване на скоростта на изхвърляне на кръв от LV с развитието на динамична обструкция; в края на периода на изтласкване, допълнително може да се наблюдава отваряне на клапаните.
Доплеровата ехокардиография позволява неинвазивно откриване на:
1. Градиент на налягане върху изходящия тракт от LV (в покой и / или по време на провокация) (фиг. 2.7);
2. Митрална регургитация;
3. Признаци на нарушена диастолична релаксация на миокарда на LV.
Особено място в диагностиката на това заболяване играе ехокардиографията с помощта на провокативни тестове, за които беше споменато по -горе.
Класическите ехокардиографски признаци на HCM са: асиметрично удебеляване на IVS, неговата хипокинезия, намаляване на кухината на LV, значително увеличаване на контрактилитета на LV и разширяване на лявото предсърдно кухина. При наличието на градиент на налягане в изходящия тракт на LV се отбелязват предно систолично движение на предната листовка на митралната клапа и затваряне на аортната клапа.
ДИФЕРЕНЦИАЛНА ДИАГНОЗА
Основните трудности обикновено възникват при диференциалната диагноза на HCM с клапна AS и CHD.
Сходството на картината на HCM и AS се дължи на наличието на систоличен шум, признаци на LV хипертрофия, синдром на ангина пекторис и синдром на малко изтласкване.
При AS обикновено има изразена калцификация на клапана и отслабване на пулсацията в периферните артерии. Систоличен шум се чува в основата на сърцето с максимум във II междуребреното пространство вдясно от гръдната кост, има груб, остъргващ характер и се провежда добре по съдовете на шията. Величината на градиента на налягането и интензитета
интензивността на шума се променя малко по време на функционалните тестове.
EchoCG при пациенти с AS разкрива:
Груба калцификация и удебеляване на аортните върхове;
Съединете ги чрез комисиони;
Значително ограничаване на систоличната дилатация;
Често е налице аортна регургитация в различна степен.
При ревматично аортно заболяване промените обикновено засягат митралната клапа - дори при липса на оформена митрална клапа, малки комисурални сраствания, които издърпват задната митрална листовка към предната листовка, са посочени върху пренесения валвулит или уплътняване и калциране на свободните ръбове на листовките.
При калцифициращия тип AS обикновено се открива и значителна калцификация на митралния апарат, главно основата на задната митрална клапа, главите на папиларните мускули и сухожилните хорди.
Сложността на диференциалната диагноза на HCM с ИБС е свързана с общото състояние на основния клиничен синдром - ангина пекторис.
ИБС се характеризира с по -късна поява на клинични симптоми на заболяването - след 40 години. Систоличен шум може да се чуе, но той е причинен от митрална регургитация, поради което се локализира на върха, извършва се в аксиларната област, има намаляващ характер и започва веднага след първия тон.
Стрес -ехокардиографията и радионуклидната вентрикулография разкриват сегментарни нарушения на миокардната контрактилност. В случай на съмнение е необходима коронарна ангиография.
Асиметрично удебеляване на IVS и ехокардиография - признаци на запушване на изходящия тракт, подобни на тези при пациенти с HCM, понякога могат да се наблюдават при пациенти с LV миокардна хипертрофия от вторичен произход - при артериална хипертония, при пациенти с хронична бъбречна недостатъчност или при спортисти. В такива случаи диференциалната диагноза с HCM представлява значителни трудности, тъй като не е изключена възможността за комбинация от двете състояния. От голямо значение за установяване на правилната диагноза принадлежи изучаването на фамилната анамнеза, наличието на синкоп и идентифицирането на аритмичен синдром.
Основните трудности обикновено възникват при диференциалната диагноза на HCM с AS и CHD.
ЛЕЧЕНИЕ
Изборът на терапевтична стратегия за HCM се основава предимно на наличието или отсъствието на запушване на изхода на LV, както и на преобладаването на определени симптоми на заболяването, причинени от патологична миокардна хипертрофия (стенокардия, задух, синкоп, и др.).
Фармакотерапия
Основните направления на медикаментозно лечение на HCM са:
1. Намаляване на степента на запушване на изходящия тракт на ЛК;
2. Антиаритмична терапия;
3. Намаляване на нуждите на миокарда от кислород.
Основното място в лечението на HCM заемат бета-блокерите, верапамил, дизопирамид.
Бета-блокери- лекарства с отрицателно инотропно и антиаритмично действие и поради това назначаването им е оправдано при пациенти с НСМ както при наличие, така и при липса на LVOT обструкция.
Използването на β-блокери значително намалява тежестта на всички клинични прояви на заболяването, главно ангина пекторис и синкоп. Намаляването на степента на запушване на изходящия тракт на LV под действието на бета-блокери се причинява от намаляване на контрактилитета на миокарда в резултат на директен отрицателен инотропен ефект и намаляване на сърдечната честота, което удължава периода на LV диастоличен пълнене и увеличава крайния си диастоличен обем.
Антиаритмичният ефект на β-блокерите се проявява в намаляване на честотата на регистрираните аритмични епизоди, но вероятността от VS не намалява.
Първото лекарство за лечение на HCM е пропранолол, а по -късно започват да се използват по -селективни лекарства (метопролол, надолол). В момента има много трудове, които показват подобрение в клиничното състояние на пациентите с HCM.
на фона на употребата на лекарства от тази група. Терапията с бета-блокери започва с ниски дози и след това ги увеличава до тези, необходими за контролиране на симптомите (в рамките на клинично приемливи). Дневната доза може да варира при отделните пациенти и с напредването на заболяването. Дозата пропранолол 240-480 mg при възрастни в многобройни проучвания е доказала своята ефективност при HCM. Някои проучвания се опитват да предписват свръхвисоки дози пропранолол (до 1000 mg / ден), но тази тактика не намира широко приложение.
Верапамил.Той се използва за лечение на пациенти с HCM от 1979 г. и се препоръчва за лечение на пациенти с LVOT обструкция и необструктивни форми.
Верапамил в доза до 480 mg / ден помага за намаляване на тежестта на симптомите, което вероятно е свързано както с отрицателен инотропен ефект, така и със намаляване на сърдечната честота, и подобряване на релаксацията на LV. Има обаче доказателства за възможността от странични ефекти на верапамил при пациенти с обструктивна HCM. Отрицателните хемодинамични ефекти на верапамил, включително случаи на влошена LVOT обструкция, белодробен оток и кардиогенен шок, са свързани с факта, че вазодилатацията преобладава над отрицателните инотропни ефекти по време на употребата му. Поради това повишено внимание при употребата на верапамил трябва да се наблюдава предимно при пациенти с тежка обструкция на лявата камера, не се показва на деца.
В международните препоръки няма индикации за възможността и безопасността на употребата на лекарството дилтиазем при пациенти с HCM. Нифедипин и други дихидропиридинови производни, които имат предимно артериолодилиращ ефект, значително намаляват последващото натоварване, поради което тяхната употреба в HCM не се препоръчва и може да доведе до увеличаване на обструкцията.
В момента се смята, че пациентите с HCM с обструкция на изходящия тракт и с камерни аритмии определено са бета-блокери. В същото време при пациенти с преобладаване на диастолична миокардна дисфункция без изразени обструктивни нарушения и със суправентрикуларни аритмии могат да се използват недихидропиридинови калциеви антагонисти. Комбинацията от лекарства от тези групи изглежда неподходяща поради опасността от тежка брадикардия и развитието на AV блокада.
При обструктивна HCM, дори при наличие на застойна NC, не се препоръчва назначаването на сърдечни гликозиди, нитрати и други периферни вазодилататори, АСЕ инхибитори и диуретици, тъй като тяхното използване води до влошаване на запушването на изходящия тракт на LV.
Изключение може да се направи за сърдечните гликозиди, когато възникне тахисистолична форма на предсърдно мъждене.
Дизопирамид(Ритмилен, Ритмодан) е антиаритмично лекарство от клас 1а (подобно на хинидин). Има индикации за намаляване на тежестта на симптомите при пациенти с LVOTO обструкция в покой. Смята се, че употребата на лекарството помага за намаляване на амплитудата на предно-систоличното движение на PSMC и обема на митралната регургитация. В допълнение, той има отрицателен инотропен ефект върху миокарда. При пациенти с HCM се използва за животозастрашаващи нарушения на камерния ритъм. Началната дневна доза е 200-300 mg (в зависимост от телесното тегло), поддържащата доза е 300-600 mg / ден. в 4 приема. Употребата на лекарството изисква наблюдение на интервала QT.
Амиодарон(кордарон) отсъства в международните препоръки за лечение на това заболяване. Използва се в HCM като антиаритмично средство с неефективността на бета-блокерите и верапамил.
Назначаването на кордарон е показано при пациенти, които имат следните ритъмни нарушения на ЕКГ или по време на холтеров мониторинг:
1. Застрашаващи живота камерни аритмии или техните предшественици (чести политопични камерни екстрасистоли, сдвоени камерни екстрасистоли, повтарящи се пароксизми на камерна тахикардия, епизоди на камерна фибрилация);
2. Пароксизми на суправентрикуларна тахикардия;
3. Пароксизми на предсърдно мъждене или предсърдно трептене. Началната (натоварваща) доза амиодарон е 800-1000
mg / ден (рядко-до 1600 mg / ден), разделено на 2-4 дози, за 1-3 седмици. Поддържащата доза е 100-400 mg / ден. в 1-2 дози.
Амиодарон може да се използва заедно с бета-блокери (с повишено внимание, с внимателно проследяване на сърдечната честота, ЕКГ и кръвното налягане), но комбинацията му с калциеви антагонисти е противопоказана.
Противопоказания за назначаването на амиодарон са:
Синусова брадикардия;
Аномалии на AV проводимостта;
Ниска фракция на изтласкване на НН (по -малко от 40%);
Удължаване на Q-Γ интервала.
При редица пациенти лекарствената терапия не стабилизира и намалява тежестта на симптомите.
Основното място във фармакотерапията на HCM заемат бета-блокери, верапамил, дизопирамид.
Хирургия
Данните на различни изследователи за необходимостта на пациентите от хирургично лечение варират и варират от 5 до 30%.
Основата за решаване на въпроса за хирургичната корекция са:
1. Надеждно откриване на висок градиент в LVOT (> 50 mm Hg);
2. Тежки симптоми (СН, ангина пекторис), рефрактерни на максимална лекарствена терапия.
Сложността на анатомичния субстрат, който причинява запушване в HOC, се отразява в големия брой различни хирургични техники, които са въведени през последните 30 години.
Миотомия-миектомия
Най -широко разпространена е операцията по дисекция и отстраняване на обрасла мускулна тъкан. (миектомия)в базалната част на IVS, известна още като операция Мороу. В някои случаи се извършва операция за резекция на хипертрофираната част на IVS с едновременна пликация на PSMC или протезна митрална клапа; в някои случаи, за да се увеличи обемът на кухината, се извършва резекция на папиларните мускули. В повечето случаи е показана ефективността на миотомия-миектомия на LV за намаляване на градиента в LVOT и подобряване на клиничните прояви. Трансаорталният достъп обикновено се предпочита за лява и дясна или комбинирана вентрикулотомия.
Ранните проучвания, използващи тази техника, бяха засенчени от високия риск от хирургична смъртност (10-15%). Тези цифри обикновено се цитират от поддръжниците на алтернативни процедури, като стимулация с две камери с предварително възбуждане на панкреаса и изкуствен инфаркт на базалната IVS. Въпреки това, в резултат на подобренията в техниката за защита на миокарда и предоперативната подготовка, периоперативният риск за пациенти с тежка хипертрофия сега е значително намален.
Всички пациенти са оперирани с помощта на AIC със сърдечен арест и умерена хипотермия (32 ° C). В случай на съпътстваща CABG, първо се прилагат коронарни анастомози. Всички други съпътстващи хирургични процедури се извършват след завършване на продължителна миектомия и възстановяване на IVS.
Доста често се усложнява от развитието на блок от ляв сноп или пълен напречен блок. В допълнение, усложненията включват интраоперативна перфорация на IVS и недостатъчен хирургичен обем поради ограничена зона на експозиция. Повечето от модификациите се основават на разработването на техники за разширен достъп до субстрата за запушване
Разширената миектомия позволява достъп до по -дълбоки структури на вентрикула, където резекцията на хипертрофираната трабекула и мобилизацията или частичното изрязване на папиларните мускули води до корекция на анатомично деформирания подклапан апарат на митралната клапа. Извършват се ниска напречна аортотомия и разрези на комиссурата на аортната клапа, които разкриват достъпа до базалната IVS.
Разпространението на хипертрофия се определя визуално и чрез палпация. В най -дълбоката точка на хипертрофираната преграда внимателно се монтира остра кука с три зъба - ретрактор, като по този начин прецизно се отделя интравентрикуларната част на обраслата мускулна тъкан. Прибиращото устройство се движи напред в зрителното поле на хирурга. По този начин мускулната маса, предназначена за резекция, е ясно фиксирана и подчертана. Надлъжните разрези се правят на 2-3 см под фиброзния пръстен на АК по посока на ретракторните зъби - първият в най -дълбоката точка на дясната коронарна клапа - директно под десния коронарен отвор и вторият - в посока на свободната стена на НН. Този разрез може дори да се простира до вмъкването на митралната листовка.
клапан. След това и двата разреза се свързват с напречен разрез, за да се отстрани напълно тъканта, държана от прибиращото устройство.
След създаването на широк и дълбок LVOT се отваря достъп до по -дълбоки LV структури. След това и двата папиларни мускула са напълно мобилизирани и всички хипертрофирани трабекули, както и хипертрофираните части на папиларните мускули се резецират. На този етап от операцията е необходима добра визуализация на хирургичното поле, за да се гарантира безопасността на резекцията. В случай на значителна обструкция на RVO, излишната тъкан на дясната камера се изрязва чрез разрез, който се затваря с тъкан или чрез поставяне на пластир.
Индуцирана от алкохол септална некроза
Друг метод за немедикаментозно лечение на пациенти с HCM е създаването на алкохолно-индуцирана септална некроза (инфаркт). Развива се картина на Q-миокарден инфаркт на предната преграда със съответни промени на ЕКГ, повишаване на активността на CPK и поява на блокада на десния клон на снопа на His, в резултат на което дебелината на миокарда на базалната част на преградата намалява. Честотата на аритмичните епизоди и рискът от внезапна смърт остават същите.
Такава терапевтична некроза води до намаляване на запушването на изходящия тракт на лявата камера, намаляване на интравентрикуларния градиент, което води до обективно подобряване на клиничния ход на заболяването.
За съжаление, има малко данни за дългосрочни резултати. Първите успешни перкутанни миокардни редукции чрез инжектиране на малко количество 96% алкохол в първия голям преграден клон на лявата предна низходяща коронарна артерия (LAPCA) бяха извършени през 1994 г. и докладвани през 1995 г.
По време на последните годинибяха предложени няколко модификации на оригиналната техника на аблация. Количеството на използвания алкохол (първоначално 3-5 ml) вече е намаляло до 2 ml или по-малко, а използването на контрола с помощта на чрево-храново ехокардиография повиши безопасността на процедурата.
В момента идентифицирането на септалния клон се извършва с въвеждането на ултразвуков контраст. Проникването на алкохол в LPNKA се изключва чрез принудително въвеждане на 1-2 ml рентгенови лъчи
контраст в целевия съд през лумена на надутия балонен катетър. От жизненоважно значение е да се предотврати увреждане на LPNCA и инфаркт на предната стена. За това се използва къс балон с подходящ размер, който се надува за 5 минути. и повече след последната инжекция на алкохол.
Ресинхронизираща терапия
От 1967 г. е известно, че апикалната електрическа стимулация на дясната камера води до намаляване на градиента на изходящия тракт на LV и намаляване на клиничните прояви. Рандомизирани проучвания показват, че възрастните пациенти са оптимални кандидати за сърдечна стимулация. За да се определи чувствителността на пациента към този вид терапия, се инсталират временни пейсмейкъри. Този вид лечение не засяга хипертрофия на миокарда и други причини за заболяването. Сърдечната стимулация е обратим и ефективен метод на лечение и представлява минимален риск за пациента и поради това възможността за нейното прилагане трябва да се обмисли своевременно сред целия спектър от терапевтични мерки.
Поради динамичния си характер, обструкцията на LVOTO може да се промени значително под въздействието на промените в пред- и след натоварването и контрактилитета на LV. Резултатите от изследванията показват, че електрическата стимулация може да бъде ефективна при пациенти с градиент в LVOT, открит както в покой, така и по време на провокация.
Средно степента на намаляване на градиента по време на пейсинг, според различни автори, варира от 30 до 50%, а в някои проучвания е била близо до 100%.
Инверсията на движението на преградата в резултат на ранна апикална стимулация, активираща апикалната област на LV преди септалната област се смята, че увеличава диаметъра на LVOT и се счита за ключов механизъм, който е в основата на намаляването на градиента в LVOT. Доказано е, че пейспингът намалява контрактилитета, особено в преградната област, и е причина за десинхронизация на LV контракцията. Това води до значително увеличаване на крайния систоличен обем на ЛК и в кривата налягане-обем се забелязва изместване надясно.
MR е тясно свързана с обструкция на лявата камера и следователно може да се предположи, че намаляването на нейната обструкция трябва да намали
ностност MR. MR, определен като съотношението на обема на регургитация към областта на лявото предсърдие, според съвременните проучвания, също намалява след инсталирането на пейсмейкър. Важно е да се отбележи, че MR остава непроменен при пациенти с персистираща патология на висок градиент или органична митрална клапа, което трябва да се счита за противопоказание за стимулиране.
Данните за ефекта на пейсинга върху диастоличната функция са противоречиви. Остро увреждане на диастоличната функция се наблюдава при редица пациенти, докато в други проучвания или няма промени, или подобрение на диастоличната функция на LV. Стимулирането, ако е успешно, трябва да се счита за дългосрочен вариант на лечение.
Монтаж на имплантируеми кардиовертер-дефибрилатори.Общоприето е, че субстратът за развитието на аритмии и VS при HCM е комбинация от хипертрофия, нарушаване на структурата на миоцитите, фиброза и анормално разпределение на разкъсаните междуклетъчни връзки (конексони). Доказано е, че степента на хипертрофия е пряко свързана с риска от VS и е независим прогностичен фактор. VS при пациенти с HCM често се свързва с физическа активност.
За повечето пациенти с повишен риск от ССЗ терапията, насочена към задвижващия механизъм, е неефективна и към лечението се добавя амиодарон и / или се имплантира кардиовертерен дефибрилатор. Предикторите на VS при HCM са фамилна анамнеза за VS при членове на семейството под 45 години, синкоп, особено повтарящи се и свързани с упражнения състояния, тежка хипертрофия на миокарда на лявата камера (дебелина на стената> 3 cm), понижаване на кръвното налягане в отговор на упражнения , припадъци на нестабилна камерна тахикардия с холтеров мониторинг. Кардиовертерен дефибрилатор трябва да бъде инсталиран при пациенти с персистираща камерна тахикардия и при пациенти, които са имали успешно лекуван епизод на VS. Използването на кардиовертер-дефибрилатор създава някои проблеми при деца и юноши, свързани с растежа, развитието, физиологичната адаптация към устройството и възможната модификация на устройството. Принципът на лечение на такива пациенти е използването на амиодарон като преходна стъпка към по-нататъшното имплантиране на кардиовертер-дефибрилатор.