Les maladies du sang sont souvent diagnostiquées aujourd'hui. On rencontre parmi eux des pathologies complexes. système circulatoire, qui conduisent à une violation de la coagulation du sang, à la suite de laquelle les gens développent une diathèse hémorragique. Cette maladie se caractérise par des saignements et des hémorragies progressifs soudains, dont la durée et la gravité varient. De tels phénomènes peuvent être observés sous la forme de petites éruptions cutanées, de grandes ecchymoses et même d'hémorragies internes. Une personne malade développe alors un syndrome anémique. En l'absence de thérapie, il est possible de développer des pathologies graves pouvant entraîner la mort.
description du problème
La diathèse hémorragique est une maladie du système circulatoire caractérisée par la tendance du corps à des saignements spontanés et à des hémorragies en raison de la présence de défauts dans un ou plusieurs mécanismes de coagulation du sang.
La médecine connaît environ trois cents variétés de ces pathologies. Selon les statistiques, dans le monde, cinq millions de personnes souffrent de cette maladie. Dans certains cas, la zone touchée est très vaste, de sorte qu'une personne a souvent des complications de la maladie. En raison de tous ces facteurs, le problème de la maladie est sous le contrôle de médecins tels que chirurgiens, hématologues, traumatologues, gynécologues et obstétriciens.
Types de maladie
Il est d'usage de distinguer deux types de maladies :
- La diathèse hémorragique congénitale chez les enfants est généralement héréditaire. Cette pathologie accompagne une personne de sa naissance à sa fin de vie. Cette forme de diathèse est compliquée par l'hémophilie, le syndrome de Glanzmann, les télangiectasies, la thrombocytopathie et d'autres pathologies. Dans ce cas, il y a absence d'un ou plusieurs éléments sanguins qui assurent sa coagulation.
- La diathèse hémorragique acquise chez les enfants et les adultes se développe à la suite d'un processus inflammatoire ou de maladies du sang. Ces pathologies comprennent la vascularite, les maladies du foie avec lésions vasculaires, l'intoxication du corps par des médicaments, maladies infectieuses, violet et autres. La diathèse acquise peut être symptomatique, ce qui apparaît dans le contexte de pathologies cardiaques système vasculaire ou tumeurs cancéreuses, et névrotique, qui se développe dans le contexte de troubles mentaux.
En outre, la diathèse peut être primaire, se développant comme une maladie indépendante, et secondaire, apparaissant à la suite de maladies précédemment transférées de nature infectieuse, d'empoisonnement ou de septicémie.
Diathèse hémorragique. Classification
En médecine, on distingue plusieurs groupes de pathologies, en fonction du trouble de l'un des facteurs de l'hémostase :
- Thrombocytopénie, ainsi que thrombocytopathie, qui se caractérisent par une hémostase plaquettaire altérée. Ce phénomène peut être observé avec un trouble système immunitaire, maladie des radiations, leucémie, purpura et ainsi de suite.
- La coagulopathie, qui est causée par un trouble de l'hémostase de la coagulation, qui contribue à l'arrêt définitif du sang. Ces phénomènes sont observés avec le développement de maladies telles que l'hémophilie, le syndrome de Stuart-Prower ou de Willebrand, la fibrinogénopathie et autres. La maladie peut se former en raison de l'utilisation d'anticoagulants et de fibrinolytiques.
- Vasopathies, qui se manifestent en violation des parois vasculaires. De telles pathologies se développent avec une vascularite, une carence en vitamines, le syndrome de Randu-Osler.
- La diathèse mixte est caractérisée par des troubles qui sont inclus dans les premier et deuxième groupes. Ce groupe comprend le syndrome de von Willebrand, la maladie thrombohémorragique, l'hémoblastose et d'autres.

Types de saignement
Les types de saignement dans la diathèse hémorragique sont les suivants:
- Le type d'hématome est caractérisé par la présence d'hématomes volumineux, de saignements après des interventions chirurgicales et d'hémorragies articulaires.
- Le type capillaire est causé par le développement de petites hémorragies sous forme de pétéchies et d'ecchymoses, de saignements nasaux, gastriques et utérins, ainsi que de saignements des gencives. Dans ce cas, des ecchymoses et de petites éruptions cutanées rouges se forment sur le corps humain.
- Le type violet est causé par la présence de petites éruptions cutanées symétriques et de taches sur la peau.
- Type microangiomateux, dans lequel les saignements se reproduisent périodiquement en raison d'une violation du développement des petits vaisseaux. Des groupes de taches bordeaux apparaissent sur la peau, qui n'ont pas tendance à se propager dans tout le corps.
- Type mixte, dans lequel des hématomes et de petites taches se forment sur la peau.
Les raisons du développement de la maladie
La diathèse hémorragique peut survenir à tout âge. La raison en est une violation de la coagulation sanguine, un trouble de la fonctionnalité des plaquettes, une augmentation de la perméabilité des parois des vaisseaux sanguins. Les personnes atteintes de certaines pathologies congénitales et acquises sont sujettes à cette maladie. Les formes primaires de la maladie sont le résultat d'une prédisposition héréditaire et sont associées à des anomalies congénitales ou à une déficience de l'un des facteurs de l'hémostase.
Les pathologies congénitales se développent en raison des maladies génétiques suivantes :
- Hémophilie. La diathèse hémorragique dans ce cas est formée en raison d'un faible niveau congénital de coagulation sanguine. Le plus souvent, une longue hémorragie interne se produit.
- Manque de prothrombine, qui se caractérise par un trouble congénital de sa synthèse.
- Thrombose, syndrome de Bernard-Soiler se caractérisent par un trouble de la fonctionnalité des plaquettes. La maladie se manifeste sur la peau.
- Le syndrome de Von Willebrand, qui est causé par l'activité anormale d'une protéine responsable de l'hémostase.
- Maladie de Glanzmann, Randu - Osler, Stuart - Prower.
De telles pathologies sont rares aujourd'hui.
Causes de la diathèse secondaire
Le plus souvent, la diathèse se développe comme une maladie acquise. Son apparition peut provoquer les maladies suivantes :
- Pathologies hépatiques et rénales, cirrhose.
- Manque de vitamine K, en particulier chez les nourrissons, ce qui entraîne une fragilité et une fragilité des vaisseaux sanguins.
- Maladies auto-immunes, à la suite desquelles les anticorps attaquent leurs propres plaquettes.
- Vascularite, septicémie, choc, à la suite duquel les vaisseaux sanguins sont endommagés.
- L'exposition à de fortes doses de rayonnement radioactif, l'exposition à la chimiothérapie contribuent au trouble de la formation des plaquettes.
- Réception de certains médicaments comme les stéroïdes.
- Maladie mentale accompagné d'automutilation.
- Âge avancé.
Symptômes et signes de pathologie

Les symptômes de la diathèse hémorragique sont souvent différents, selon la maladie dont ils sont les conséquences. Les signes de la pathologie sont vifs. En cas de lésion des parois vasculaires chez une personne, une petite éruption cutanée se forme dans tout le corps, y compris sur les muqueuses. Dans certains cas, il y a des douleurs dans l'abdomen et les articulations, la présence de sang dans les urines et un gonflement.
Avec le développement de la coagulopathie, le patient présente soudainement des saignements, des hémorragies sous-cutanées étendues, qui modifient la couleur de la peau. La personne développe alors une anémie. Avec l'hémophilie chez les enfants au cours de la première année de vie, des saignements de nez et des hémorragies sous-cutanées, des arthralgies et un gonflement des articulations sont observés.
Dans les cas graves, la diathèse entraîne l'apparition de symptômes, de nausées et de vomissements avec du sang, syndrome douloureux dans l'abdomen et le bas du dos, hypertrophie du foie et de la rate, anémie, dysurie. Avec l'anémie, une personne a une faiblesse, une hypotension, une tachycardie, des vertiges, une pâleur de la peau.
Signes de pathologie chez les enfants et les femmes enceintes
Chez l'enfant, la diathèse hémorragique (photo ci-contre) peut être l'un des signes de la leucémie aiguë. La pathologie se manifeste souvent par des saignements gingivaux lors de la poussée dentaire, des saignements de nez, des éruptions cutanées, des douleurs dans les articulations et leurs déformations, ainsi que des hémorragies de la rétine, des vomissements et des défécations mêlées de sang. Les adolescentes ont des règles abondantes.
Souvent, la thrombocytopathie chez les enfants n'agit pas comme une maladie, elle indique l'immaturité des plaquettes. Ce phénomène disparaît après la puberté. Mais les médecins recommandent de prendre ce phénomène au sérieux, car souvent, sous l'influence de facteurs négatifs, une hémorragie interne se produit lors de blessures ou d'un accident vasculaire cérébral.

Chez la femme enceinte, avec cette pathologie, toxicose tardive, hydropisie, il existe un risque de fausse couche, d'insuffisance placentaire, naissance prématurée... Chez ces femmes, les enfants naissent souvent prématurément, ils souffrent d'hypoxie, de retard de développement.
Complications et conséquences
Les complications de cette pathologie sont :
- anémie chronique;
- l'apparition d'allergies, qui contribuent également au développement de saignements;
- Hépatite B;
- Infection au VIH en cas de transfusions sanguines répétées ;
- limitation ou immobilité complète des articulations;
- engourdissement et paralysie des tissus;
- hémorragie intracrânienne, paresthésie, parésie ou paralysie ;
- cécité, accident vasculaire cérébral;
- coma.
Ces complications ne surviennent pas chez tous les patients, elles apparaissent en fonction du type de pathologie et des facteurs négatifs associés. Avec un traitement rapide, le développement de conséquences négatives peut être évité. Mais avec une perte de sang incontrôlée, des complications se développeront.

Mesures diagnostiques
Lorsqu'il contacte un médecin, il étudie les facteurs qui pourraient provoquer le développement de la maladie, la forme et la prévalence de la pathologie.
La diathèse hémorragique est diagnostiquée à l'aide des techniques suivantes :
- Tests en laboratoire sang, selles et urine.
- Analyse du sérum sanguin pour déterminer la teneur en oligo-éléments dans le corps.
- Test de coagulation sanguine.
- Coagulogramme.
- Tests de génération de thromboplastine et de Coombs, analyses de thrombine et de prothrombine.
- Etudes immunologiques.
- Echographie des reins et du foie.
- Études du cerveau inerte.
- Radiographie des articulations.
Après un examen complet, le médecin met diagnostic final et prescrit un traitement approprié.

Activités de traitement
Le traitement de la diathèse hémorragique doit être complexe et comporter les étapes suivantes :
- Thérapie médicamenteuse, qui vise à augmenter le taux de plaquettes, à augmenter la coagulation du sang, à renforcer les parois vasculaires. Dans ce cas, des vitamines, de l'acide aminocaproïque, des glucocorticoïdes, des immunosuppresseurs sont prescrits.
- Arrêt des saignements. Pour ce faire, le médecin utilise un garrot, une éponge spéciale, des cotons-tiges et une bouillotte avec de la glace.
- Opération. Souvent, l'extraction de la rate est effectuée pour augmenter la durée de vie des cellules sanguines, ainsi que pour éliminer le vaisseau pathologique, qui est remplacé par une prothèse, et pour percer la cavité articulaire pour éliminer le sang.
- Physiothérapie.
- Transfusion sanguine pour augmenter le nombre de plaquettes et d'électrocytes.
Après la guérison de la diathèse hémorragique, directives cliniques donné par le médecin traitant. Il prescrit généralement un régime qui implique l'élimination complète des aliments instantanés, des conservateurs, des plats cuisinés et des sauces. Pour augmenter la concentration de plaquettes, vous pouvez manger des légumes comme des betteraves, du brocoli, du céleri, des tomates, ainsi que du foie de bœuf.
Prévision
L'évolution de la maladie et son pronostic peuvent être différents. Avec un traitement efficace en temps opportun, le pronostic sera favorable. En l'absence de traitement ou de développement de complications graves, la mort est possible. Par conséquent, il est important de diagnostiquer la maladie en temps opportun afin de réduire le risque de développer des complications à l'avenir.

Prophylaxie
Que faut-il faire pour identifier une diathèse hémorragique ? Les recommandations des médecins sont sans ambiguïté - rechercher la présence d'une prédisposition génétique à la pathologie. Il faut aussi planifier une grossesse, passer les tests et consultations nécessaires, mener image saine la vie pendant la période de procréation. Il est également important de bien manger, de subir régulièrement des examens et des examens programmés, d'abandonner les dépendances et l'utilisation incontrôlée de médicaments, d'éviter les blessures et les blessures et de surveiller votre santé et celle de vos enfants.
En respectant toutes les recommandations et prescriptions du médecin, vous pouvez éviter les complications graves et dangereuses de cette maladie. Comme il est de nature chronique, il est nécessaire de se soumettre périodiquement à un examen par des spécialistes et de suivre un traitement.
Lire aussi :
|
Diathèse hémorragique – conditions pathologiques caractérisée par une augmentation des saignements en raison de l'insuffisance d'un ou plusieurs éléments de l'hémostase.
Classification étiopathogénétique des diathèses hémorragiques :
a) héréditaire- associé à des modifications pathologiques génétiquement déterminées de la paroi vasculaire, à des anomalies des mégacaryocytes, des plaquettes, des protéines plasmatiques adhésives et des facteurs plasmatiques du système de coagulation sanguine.
b) acquis- pour les raisons suivantes :
1) en raison de dommages primaires à la paroi vasculaire: télangiectasies hémorragiques héréditaires de Randu-Osler ; vascularite hémorragique Schönlein-Henoch ; Syndrome d'Ehlers-Danlos, hypovitaminose C et B, etc.
2) en raison de dommages primaires à la lignée mégacaryocyte-plaquette:
1.thrombocytopénie(purpura thrombocytopénique idiopathique, augmentation de la consommation de plaquettes dans la CIVD, redistribution et dépôt des plaquettes dans la rate)
2.thrombocytopathie(thrombosthénie de Glyantsman, maladie de von Willebrand)
3) en raison d'un trouble de la coagulation sanguine (coagulopathie): dépendant de la vitamine K (avec fonction hépatique insuffisante, altération de l'absorption de la vitamine K, carence nutritionnelle en vitamine K, etc.) ; insuffisance hépatique avec déficit en facteurs de coagulation, etc.; inhibiteurs pathologiques de la coagulation ("anticoagulant lupique")
4) en raison de violations complexes de divers liens du système de coagulation: syndromes aigus de coagulation intravasculaire disséminée
Types de saignements :
1) capillaire (microcirculatoire, tacheté de pétéchies, meurtri)- éruptions pétéchiales, ecchymoses et ecchymoses sur la peau et les muqueuses ; souvent associé à des saignements des muqueuses - saignements de nez, ménorragies (thrombocytopénie, thrombocytopathie)
2) hématome- hémorragies douloureuses et intenses du tissu sous-cutané, des muscles, des grosses articulations, du péritoine et de l'espace rétropéritonéal ; parfois saignements rénaux et gastro-intestinaux (hémophilie A et B)
3) capillaire-hématome mixte (ecchymose-hématome)- des éruptions cutanées accompagnées d'ecchymoses pétéchiales associées à des hémorragies denses étendues et à des hématomes ; les hémorragies articulaires sont rares
4) violet vasculaire- éruptions hémorragiques ou érythémateuses (sur une base inflammatoire) de différentes tailles; se produisent facilement dans les endroits où la peau est comprimée par une ceinture, des chaussettes (vascularite)
5) angiomateux- persistante, strictement localisée et liée à la pathologie vasculaire locale de l'hémorragie (télangiectasie, hématome)
Purpura thrombocytopénique- un groupe de maladies associées selon le principe d'une pathogenèse unique de la thrombocytopénie (raccourcissement de la durée de vie des plaquettes en raison de l'action d'anticorps dirigés contre elles ou d'autres mécanismes de leur destruction).
Normalement, le nombre de plaquettes est de 150-450 / l, leur niveau minimum est La figure critique de Frank- 30 / l (en dessous, des hémorragies spontanées peuvent être attendues).
Étiologie du purpura thrombocytopénique idiopathique inconnu au coeur de la pathogenèse- fixation à la surface des plaquettes IgG dirigées contre l'AH de ses propres plaquettes ® augmentation de la phagocytose des plaquettes par les macrophages de la rate et du foie ® augmentation de la destruction des plaquettes, raccourcissant leur espérance de vie (de 7 à 10 jours normalement à plusieurs heures)
Distinguer entre les formes aiguës (généralement chez les enfants de 2 à 6 ans, ne dure pas plus de 6 mois, caractérisée par un syndrome hémorragique prononcé d'apparition rapide et soudain suivi d'une récupération ou d'une rémission spontanée) et chroniques (chez l'adulte, dure plusieurs années) la maladie.
Présentation clinique de la forme chronique du purpura thrombocytopénique idiopathique.
La maladie est plus typique chez les femmes, se développe progressivement, progressivement, est de nature chronique, récurrente avec une modification des périodes d'exacerbation par des périodes de rémission de durée variable
Syndrome hémorragique :
a) saignement de type pétéchial-spotty sous forme d'hémorragies cutanées, localisées le plus souvent sur la face antérieure du corps, les membres supérieurs et inférieurs, aux sites d'injection; la couleur des éruptions hémorragiques change en fonction de l'âge de leur apparition : d'abord rouge-violet, puis bleuâtre, verdâtre, jaune (« bleus fleuris »)
b) saignement des muqueuses: nasal, gingival, polyménorrhée, dans les cas graves - rénal (macrohématurie), pulmonaire (hémoptysie), gastro-intestinal (méléna, vomissements Marc de café") Et autres saignements
Des hémorragies intracérébrales et sous-arachnoïdiennes, des hémorragies de la sclérotique ou de la rétine de l'œil, des saignements sévères après amygdalectomie, extraction dentaire, pendant la chirurgie et l'accouchement peuvent être observés
Avec saignements fréquents et abondants - signes d'anémie post-hémorragique (pâleur de la peau et des muqueuses visibles, etc.)
Diagnostic du purpura thrombocytopénique :
1. KLA : diminution du nombre total de plaquettes< 100*10 9 /л, их морфологические изменения (анизоцитоз, пойкилоцитоз и шизоцитоз); преобладают тромбоциты больших размеров (3-4 нм в диаметре),
de petites plaquettes et fragments de plaquettes ("microparticules") sont trouvés; anémie hypochrome; leucocytose neutrophile modérée avec un déplacement vers la gauche après une perte de sang abondante
2. Étude de l'hémostase : une augmentation du temps de saignement (jusqu'à 15 minutes ou plus à un rythme de 2,0 à 7,5 minutes) ; altération de la rétraction d'un caillot sanguin
3. Immunogramme : une teneur accrue en IgG en antigènes plaquettaires, une augmentation des complexes immuns circulants
Traitement du purpura thrombocytopénique :
1. Prednisolone ou méthylprednisolone à la dose initiale de 1 mg/kg/jour ® aucun effet 5-7 jours ®
augmenter la dose à 2-3 mg / kg / jour (une thérapie par le pouls avec de la méthylprednisolone est possible); la durée de l'hormonothérapie est de 1 à 4 mois à six mois, les hémorragies s'arrêtent dans les premiers jours de traitement et les plaquettes augmentent progressivement
2. Si GCS est inefficace dans les six mois - splénectomie
3. En cas d'inefficacité de la splénectomie - chimiothérapie (vincristine, azathioprine, cyclophosphamide en association avec la prednisone)
4. Il est possible d'utiliser de fortes doses d'Ig IV humaines (sandoglobuline 0,25 g/kg, puis une dose d'entretien de 0,5 mg/kg tous les 15 jours) - l'immunoglobuline ferme les récepteurs des macrophages et ils arrêtent d'absorber les plaquettes
5. Plasmaphérèse pour l'élimination de l'AT
6. Les cures de dicinone (étamsylate) 1,5 g/jour par voie orale pendant 14 jours
7. Les perfusions de plaquettes ne sont pas indiquées et ne sont utilisées que pour des raisons de santé
Vascularite hémorragique (maladie de Scheilein-Henoch)- vascularite, caractérisée par le dépôt de complexes immuns contenant des IgA dans les parois des petits vaisseaux (artérioles, capillaires, veinules) avec éruptions hémorragiques symétriques caractéristiques, arthrite, syndrome abdominal et glomérulonéphrite.
Épidémiologie: 1ère place parmi vascularite systémique; plus souvent les enfants et les jeunes de moins de 20 ans sont malades
Étiologie de la vascularite hémorragique :
a) allergie médicamenteuse
b) l'utilisation de sérums et de vaccins
c) piqûres d'insectes
d) allergie au froid
e) idiosyncrasie alimentaire (lait, œufs, fraises, etc.)
Les agents infectieux (le plus souvent le streptocoque b-hémolytique du groupe A, les mycoplasmes, les virus) ne sont qu'un facteur de résolution et non un facteur causal.
Pathogenèse de la vascularite hémorragique : inflammation des complexes immuns avec formation de complexes immuns circulants (CIC) avec dépôt d'IgA ® CEC dans les microvaisseaux de la peau et les organes internes ®
microvascularite destructrice et destructrice-productive avec microthrombose multiple, augmentation de la perméabilité de la paroi vasculaire avec libération de protéines et d'érythrocytes du lit vasculaire
Le tableau clinique de la vascularite hémorragique :
a) le début est le plus souvent aigu, soudain, avec une augmentation de la température à subfébrile, une faiblesse, un malaise
b) syndrome cutané- le principal syndrome clinique présent chez tous les patients :
Éruption hémorragique symétrique sujette à la fusion, à points fins (2-3 mm de diamètre), facilement identifiable et palpable
L'éruption est plus souvent située sur la surface des extenseurs des membres supérieurs et inférieurs, sur les fesses, moins souvent sur le tronc et presque jamais sur les muqueuses, augmente en position verticale
Les éléments de l'éruption disparaissent 2-3 jours après l'apparition
On observe généralement 2 à 4 vagues d'éruptions cutanées, donc des éléments anciens et frais sont présents sur la peau en même temps (une image d'apparence panachée)
Le purpura drainant peut entraîner la formation de cloques hémorragiques, qui se rompent ensuite avec la formation d'érosions profondes et d'ulcères
c) syndrome articulaire- survient chez 2/3 des patients, plus souvent chez l'adulte :
Atteinte symétrique des grosses articulations, principalement des membres inférieurs (genou, cheville) avec œdème périarticulaire, douleur, fonction limitée, mais pas de modifications osseuses
Caractérisé par une combinaison d'arthrite avec myalgie et œdème des membres inférieurs
Durée du syndrome articulaire 1-2 semaines
d) syndrome abdominal- chez plus de 50 % des patients, elle survient en raison d'œdèmes et d'hémorragies au niveau du péritoine, de la paroi intestinale (le plus souvent les coupes initiale et finale intestin grêle, moins souvent des modifications hémorragiques et ulcéreuses-nécrotiques dans le côlon, des lésions de l'œsophage et de l'estomac sont observées):
L'apparition soudaine de douleurs intenses au niveau de l'abdomen à type de coliques intestinales, localisées dans le mésogastre, de crampes, parfois accompagnées de nausées, de vomissements (y compris sanglants)
Des saignements gastro-intestinaux typiques avec des selles goudronneuses peuvent se développer
Complications : invagination (plus souvent chez l'enfant), obstruction intestinale, perforation avec péritonite
Durée du syndrome abdominal de jours à 10
e) syndrome rénal- chez 10 à 50 % des patients, plus souvent chez l'adulte :
La glomérulonéphrite survient généralement dans les 4 à 6 premières semaines après le début de la maladie
Les principales manifestations sont la macrohématurie isolée ou son association avec une protéinurie modérée ; le syndrome néphrotique et l'hypertension sont rares
Avec une hématurie et une protéinurie persistantes, le développement d'une insuffisance rénale chronique est possible.
f) syndrome pulmonaire- capillarite des cloisons interalvéolaires avec hémorragies au niveau des alvéoles :
Toux peu abondante, hémoptysie, essoufflement
Incohérence du maigre tableau auscultatoire du degré de modifications radiologiques (infiltrats multiples dans les sections médianes et inférieures)
Parfois pleurésie hémorragique
g) dommages cardiaques- péricardite hémorragique, hémorragies dans l'endocarde, ECG peut montrer des changements de crise cardiaque
h) dommages au système nerveux central- maux de tête paroxystiques, vertiges, larmoiements, irritabilité, avec œdème des membranes - symptômes méningés, crises épileptiformes, etc.
Variantes cliniques de la vascularite hémorragique :
a) forme fulminante - mort en quelques jours d'un accident vasculaire cérébral ou d'une hémorragie intestinale
b) forme aiguë - de plusieurs semaines à plusieurs mois; à la fin - cours de récupération ou récurrent
c) évolution récurrente - les rechutes sont caractéristiques avec des périodes de rémission de durée variable (de plusieurs mois à un an ou plus)
Diagnostic de la vascularite hémorragique :
1. Les données de laboratoire ne sont pas spécifiques:
a) KLA : leucocytose modérée avec un déplacement vers la gauche, augmentation de la VS (avec forme abdominale et surtout avec GN) ; souvent éosinophilie jusqu'à 10-15%; les plaquettes sont normales
b) OAM : hématurie, protéinurie (avec GN)
c) LHC : dysprotéinémie en période aiguë due à une augmentation des IgA
G) analyse positive fèces pour sang occulte avec syndrome abdominal
2. Recherche instrumentale:
a) biopsie cutanée et son étude immunohistochimique - infiltrats de leucocytes périvasculaires, dépôt de complexes immuns contenant des IgA
b) FGDS - détection d'érosions dans l'œsophage, l'estomac, le duodénum, etc.
Traitement:
1. Repos au lit, limitant la consommation d'aliments extractifs, salés, épicés
2. La principale méthode de traitement est l'héparine: 300 unités / kg / jour n / a (la dose est répartie uniformément sur plusieurs injections toutes les 4 à 6 heures); contrôle - temps de thrombine (optimal) ou temps de coagulation (indicateur moins sensible), il faut réaliser leur allongement de 2 fois
3. Avec un manque d'effet de l'héparine :
a) pour reconstituer l'antithrombine III - FFP, 300-400 ml IV
b) un acide nicotinique 0,1% - 1 ml (1 amp) en physique. solution par voie intraveineuse goutte à goutte lentement pour stimuler la fibrinolyse
c) agents antiplaquettaires - pentoxifylline / trental 2% solution 5 ml par 200 ml physique. solution iv goutte à goutte
d) traitement de l'inflammation - AINS, cures courtes de corticoïdes, avec GN évoluant rapidement - thérapie par impulsions avec de la méthylprednisolone 1000 mg/jour IV pendant 3 jours
e) avec un niveau élevé de CEC, évolution persistante prolongée de la vascularite - plasmaphérèse, immunosuppresseurs
Coagulopathies héréditaires- des troubles génétiquement déterminés du système de coagulation du sang associés à une déficience ou à des anomalies moléculaires des facteurs de coagulation plasmatiques et des composants du système kallikréine-kinine participant à ce processus ; 97 % de toutes les coagulopathies héréditaires sont l'hémophilie.
La structure de l'hémophilie :
a) hémophilie A (85-90%)- la coagulopathie, qui est basée sur un déficit de la partie coagulante du facteur de coagulation plasmatique VIII - VIII : C (globuline antihémophilique A) ou ses modifications moléculaires
b) hémophilie B / maladie de Christmas (6-13 %)- la coagulopathie, qui est basée sur un déficit de l'activité du facteur IX (le composant plasmatique de la thromboplastine)
c) hémophilie C / maladie de Rosenthal (0,3-0,5%)- la coagulopathie, qui est basée sur un déficit en facteur de coagulation XI (participe à la voie interne d'activation de la coagulation sanguine)
Étiologie de l'hémophilie : les maladies héréditaires (les hémophilies A et B sont héréditaires selon le type X-récessif - la plupart des hommes sont malades, l'hémophilie C se transmet par voie autosomique - les hommes et les femmes sont malades).
Pathogénèse: une carence en facteurs de coagulation sanguine entraîne une augmentation du temps de coagulation du sang total et le développement d'un syndrome hémorragique (hémorragie de type hématome).
La gravité de l'hémophilie est déterminée par l'activité du facteur de coagulation dans le sang.:
a) forme légère - activité supérieure à 5%
b) forme modérée - activité 3-5%
c) forme sévère - activité 1-2%
d) forme extrêmement sévère - activité inférieure à 1%
Manifestations cliniques de l'hémophilie :
La maladie débute généralement dans l'enfance, la plupart des garçons (sauf pour l'hémophilie C) sont malades; l'hémophilie légère peut commencer à l'adolescence
Les premiers symptômes saignent avec des blessures mineures des muqueuses
Caractérisé par une alternance de périodes de saignement accru et de bien-être relatif
Saignement de type hématome :
a) saignements abondants et prolongés après toutes blessures et opérations, même mineures (extraction dentaire, morsure de la lèvre et de la langue, etc.)
b) hémarthrose des grosses articulations des extrémités avec des blessures mineures (détérioration de l'état de santé général, fièvre, douleur intense, hyperémique, tendue, peau chaude au toucher); la récurrence de l'hémarthrose aiguë conduit à une arthrose hémorragique destructrice chronique, entraînant une déformation et une mobilité limitée, une fonte musculaire
c) gros hématomes intermusculaires, intramusculaires, sous-périostés, rétropéritonéaux, provoquant la destruction des tissus environnants (pseudotumeurs hémophiles), entraînant une altération de la mobilité des articulations lorsque l'hématome comprime les troncs nerveux, les tendons, les muscles
d) hématomes rétrobulbaires avec lésion oculaire avec perte de vision
e) hémorragies à la tête et moelle épinière
f) saignement rénal persistant (dans 30% des cas)
g) saignement gastro-intestinal et tendance à l'ulcération
h) saignements retardés (c'est-à-dire survenant après 1 à 5 heures) après des blessures et des opérations
Syndrome anémique (faiblesse, pâleur, vertiges, etc.) avec saignement prolongé
Diagnostic de l'hémophilie :
1. KLA : avec hématomes et saignements étendus - anémie post-hémorragique de gravité variable ; numération plaquettaire normale
2. Coagulogramme : la durée du saignement est normale (2,0-7,5 minutes) ; la rétraction du caillot sanguin n'est pas altérée;
le temps total de coagulation du sang dans un tube à essai est allongé (normalement - 5-7 minutes), l'APTT est allongé (l'indicateur le plus important de l'hémophilie associé aux facteurs VIII, IX et XI, normalement 35-40 secondes), le temps de prothrombine ( caractérise le processus de coagulation lorsqu'il est déclenché par un mécanisme externe) - normal (11-14 sec) et temps de thrombine (caractérise l'état de l'étape finale du processus de coagulation) - normal (14-16 sec).
3. LHC : diminution de l'activité des facteurs de coagulation sanguine (VIII, IX ou XI, selon le type d'hémophilie)
Traitement de l'hémophilie :
1. La première priorité est thérapie de remplacement avec hémopréparations, cependant, elle s'accompagne d'un certain nombre de complications :
a) transmission de l'infection (VIH, hépatite B, C)
b) réactions pyrogènes et allergiques
c) la formation d'un inhibiteur du facteur de coagulation requis (!)
d) transfert d'agents pathogènes non viraux (prions - encéphalopathies spongiformes à transmission : maladie de Creutzfeldt-Jakob et ses variantes, encéphalite spongiforme bovine).
e) surcharge volumique (cryoprécipité et FFP uniquement)
f) hémolyse, etc.
Il existe 3 générations de médicaments de substitution :
1ère génération - cryoprécipité et plasma frais congelé (FFP)
II génération - concentrés de facteurs de coagulation plasmatiques de faible et moyen pureté
Génération III - concentrés de facteurs de coagulation plasmatiques de haute pureté, facteurs recombinants (facteur VIII purifié recombinant et monoclonal; facteur IX purifié monoclonal).
Doses nécessaires de facteurs de saignement chez les hémophiles :
| Activité clinique | VIII | IX |
| Saignements articulaires légers ou mouchoir doux | 20 unités / kg une fois par jour | 40 unités / kg une fois par jour |
| Saignements graves dans les articulations ou les tissus mous | 40 unités / kg 1 fois, puis 20 unités toutes les 12 heures | 80 unités / kg 1 fois, puis 40 unités toutes les 12 heures |
| Syndrome du "compartiment" (syndrome d'augmentation de la pression intrafasciale avec hématomes sous-fasciaux) | 40 unités / kg 1 fois, puis 20 unités toutes les 12 heures jusqu'à résolution | 80 unités / kg 1 fois, puis 40 unités toutes les 12 heures jusqu'à résolution |
| Lacération avec points de suture | 20 unités / kg 1 fois lors de la suture, puis tous les deux jours jusqu'à ce que les sutures soient retirées | 40 unités / kg 1 fois lors de la suture, puis tous les deux jours jusqu'à ce que les sutures soient retirées |
| Nettoyage et remplissage des dents | 20 unités / kg une fois par jour, etc. | 40 unités / kg une fois par jour, etc. |
Tous les médicaments antihémophiliques sont injectés par voie intraveineuse en jet immédiatement après leur reconservation ! La demi-vie du facteur VIII est de 12 heures, avec l'hémophilie A il est administré 2 fois/jour ; la demi-vie du facteur IX est de 24 heures, avec l'hémophilie B il est administré 1 fois/jour. Les médicaments antihémophiliques ne doivent pas être dilués, injectés par voie intraveineuse avec d'autres substituts sanguins (car leur concentration diminue en raison de la dilution) !!!
2. En raison d'un traitement de substitution formation possible d'un inhibiteur du facteur VIII- neutralisant les IgG (environ 15 % des patients atteints d'hémophilie A sévère et 4 % d'hémophilie B) ; Le taux d'inhibiteur est déterminé par le taux de facteur VIII restant dans le plasma normal après 2 heures d'incubation avec le plasma du patient, et est mesuré en unités Bethesda (EB) :
Titre faible de l'inhibiteur (10 EB et moins) - une augmentation de la quantité de facteur introduit est indiquée
Titre élevé d'un inhibiteur (40 EB et plus) - une plasmaphérèse est montrée (pour éliminer les IgG) + une forte dose du facteur injecté + GCS (prednisolone jusqu'à 4-6 mg / kg / jour)
3. Autres médicaments pour le traitement de l'hémophilie :
a) desmopressine IV pour les adultes 1-4 mcg / jour, pour les enfants - 0,4 mcg / jour - augmente la concentration du facteur VIII de 300 à 400 % 5 heures après l'administration
b) une préparation de complexe prothrombine (PPSB, Autoplex, Feiba), un complexe prothrombine activé (APPSB) - contiennent plusieurs facteurs de coagulation plasmatique (II, IX, X).
4. Arrêter le saignement: acide aminocaproïque 4-12 g/jour en 6 prises ou autres inhibiteurs de la fibrinolyse (pamba - acide aminométhylbenzoïque, acide transamcha - tranexamique) + thérapie hémostatique locale (applications sur la surface saignante d'une éponge hémostatique, lotions avec une solution de thrombine, acide aminocaproïque, etc.)
5. Traitement de l'hémarthrose:
a) thérapie de substitution en période aiguë(commencer le plus vite possible)
b) repos au lit 5-7 jours
c) avec des hémorragies sévères : ponction de l'articulation avec aspiration de sang et introduction de GCS dans sa cavité
d) immobilisation du membre affecté pendant 3-4 jours, puis - thérapie par l'exercice et physiothérapie (sous le couvert d'une thérapie de substitution)
 Diathèse hémorragique. Classification, étiologie, pathogenèse, tableau clinique, diagnostic, traitement. VOLODICHEVA ELENA MIKHAILOVNA Hématologue en chef de la région de Toula Cand. Sciences 1
Diathèse hémorragique. Classification, étiologie, pathogenèse, tableau clinique, diagnostic, traitement. VOLODICHEVA ELENA MIKHAILOVNA Hématologue en chef de la région de Toula Cand. Sciences 1
 Syndrome de diathèse hémorragique n La diathèse hémorragique est un syndrome dont les principaux signes cliniques sont une augmentation des saignements, une tendance au re-saignement et à l'hémorragie, spontanée ou après des blessures mineures. 2
Syndrome de diathèse hémorragique n La diathèse hémorragique est un syndrome dont les principaux signes cliniques sont une augmentation des saignements, une tendance au re-saignement et à l'hémorragie, spontanée ou après des blessures mineures. 2

 n Les hémorragies surviennent lorsque le système hémostatique est perturbé. les parois des vaisseaux sanguins et une thrombose suffisamment rapide de ces derniers. 4
n Les hémorragies surviennent lorsque le système hémostatique est perturbé. les parois des vaisseaux sanguins et une thrombose suffisamment rapide de ces derniers. 4

 Composants du système d'hémostase : Facteurs de coagulation plasmatique Il existe 13 facteurs de coagulation dans le plasma sanguin n Facteurs de coagulation cellulaire. Les plaquettes sont impliquées dans toutes les phases du processus hémostatique. A également révélé des facteurs de coagulation érythrocytaire, leucocytaire n Composant vasculaire. l'endommagement de la paroi vasculaire entraîne la libération d'une substance thromboplastique active. ... n 6
Composants du système d'hémostase : Facteurs de coagulation plasmatique Il existe 13 facteurs de coagulation dans le plasma sanguin n Facteurs de coagulation cellulaire. Les plaquettes sont impliquées dans toutes les phases du processus hémostatique. A également révélé des facteurs de coagulation érythrocytaire, leucocytaire n Composant vasculaire. l'endommagement de la paroi vasculaire entraîne la libération d'une substance thromboplastique active. ... n 6
 Le premier moyen est une violation du lien plaquettaire de l'hémostase - une diminution du nombre de plaquettes (thrombocytopénie) ou une violation de celles-ci état fonctionnel(thrombocytopathie). Le plus souvent en pratique clinique le purpura thrombocytopénique (maladie de Werlhof) se produit.La deuxième voie est une violation du lien plasmatique de la pathogenèse due à une déficience en facteurs de coagulation ou du système anticoagulant - coagulopathie. L'hémophilie est un représentant typique de ce groupe. La troisième voie est la violation de la paroi vasculaire de la vasopathie; vascularite hémorragique. 7
Le premier moyen est une violation du lien plaquettaire de l'hémostase - une diminution du nombre de plaquettes (thrombocytopénie) ou une violation de celles-ci état fonctionnel(thrombocytopathie). Le plus souvent en pratique clinique le purpura thrombocytopénique (maladie de Werlhof) se produit.La deuxième voie est une violation du lien plasmatique de la pathogenèse due à une déficience en facteurs de coagulation ou du système anticoagulant - coagulopathie. L'hémophilie est un représentant typique de ce groupe. La troisième voie est la violation de la paroi vasculaire de la vasopathie; vascularite hémorragique. 7
 Classification. 1. Coagulopathie : n Hémophilie A, B, C n Hypoconvertinémie, absence de facteurs V, III, X, XIII 2. Violation du système mégacaryocyte-plaquette n Thrombocytopénie (PTI, symptomatique) n Thrombocytopathie 3. Violation du système vasculaire : n Vascularite hémorragique n Randu-Osler. huit
Classification. 1. Coagulopathie : n Hémophilie A, B, C n Hypoconvertinémie, absence de facteurs V, III, X, XIII 2. Violation du système mégacaryocyte-plaquette n Thrombocytopénie (PTI, symptomatique) n Thrombocytopathie 3. Violation du système vasculaire : n Vascularite hémorragique n Randu-Osler. huit
 Types cliniques de saignement n Au cœur des manifestations cliniques de la diathèse hémorragique se trouve le syndrome hémorragique. Une anamnèse soigneusement recueillie et un examen objectif permettent d'identifier le type de saignement, ce qui est d'une grande importance pour le diagnostic différentiel de la diathèse hémorragique. Il existe cinq types cliniques de saignement. neuf
Types cliniques de saignement n Au cœur des manifestations cliniques de la diathèse hémorragique se trouve le syndrome hémorragique. Une anamnèse soigneusement recueillie et un examen objectif permettent d'identifier le type de saignement, ce qui est d'une grande importance pour le diagnostic différentiel de la diathèse hémorragique. Il existe cinq types cliniques de saignement. neuf
 n n n n Le type d'hématome se caractérise par les symptômes suivants : - hémorragies massives, profondes, tendues et douloureuses dans les grosses articulations, les muscles, sous les aponévroses et les fascias, dans le tissu sous-cutané et rétropéritonéal ; - saignements post-traumatiques ou postopératoires spontanés abondants, y compris des organes internes (gastro-intestinaux, rénaux), qui souvent ne surviennent pas immédiatement après une intervention chirurgicale ou une blessure, mais après quelques heures. Le type à taches pétéchiales (ecchymoses) se caractérise par : - des hémorragies superficielles dans la peau, elles ne sont pas tendues, indolores, ne compriment pas et ne détruisent pas les tissus environnants ; - ecchymoses (ecchymoses) sur la peau, qui sont plus grosses que les pétéchies, mais pas non plus tendues et indolores; pétéchies et ecchymoses surviennent spontanément ou au moindre traumatisme. - saignements gingivaux, nasaux et utérins. Dix
n n n n Le type d'hématome se caractérise par les symptômes suivants : - hémorragies massives, profondes, tendues et douloureuses dans les grosses articulations, les muscles, sous les aponévroses et les fascias, dans le tissu sous-cutané et rétropéritonéal ; - saignements post-traumatiques ou postopératoires spontanés abondants, y compris des organes internes (gastro-intestinaux, rénaux), qui souvent ne surviennent pas immédiatement après une intervention chirurgicale ou une blessure, mais après quelques heures. Le type à taches pétéchiales (ecchymoses) se caractérise par : - des hémorragies superficielles dans la peau, elles ne sont pas tendues, indolores, ne compriment pas et ne détruisent pas les tissus environnants ; - ecchymoses (ecchymoses) sur la peau, qui sont plus grosses que les pétéchies, mais pas non plus tendues et indolores; pétéchies et ecchymoses surviennent spontanément ou au moindre traumatisme. - saignements gingivaux, nasaux et utérins. Dix
 n n n n n Pour un type mixte, contusion-hématome, sont caractéristiques : - les éruptions pétéchiales et les contusions qui apparaissent avant les hématomes ; - les hématomes dans le tissu rétropéritonéal et sous-cutané sont généralement peu nombreux, mais de grande taille, il n'y a pratiquement pas d'hémorragies dans les articulations et leur déformation. Le type vasculo-violet se caractérise par : - des éruptions cutanées hémorragiques, le plus souvent symétriques ; les éléments de l'éruption sont limités, légèrement surélevés au-dessus de la peau, leur apparition est souvent précédée de cloques ou de vésicules, qui sont alors trempées de sang ; les éléments hémorragiques peuvent fusionner, l'épiderme au-dessus d'eux se nécrose avec formation d'une croûte; après la disparition de l'éruption cutanée, les foyers de pigmentation de la peau restent; - saignement des organes internes - gastro-intestinal, rénal. Le type angiomateux se caractérise par: - des saignements persistants et répétés d'une ou deux, moins souvent plus de localisations (par exemple nasale, pulmonaire); - l'absence d'hémorragies spontanées et post-traumatiques au niveau de la peau, du tissu sous-cutané. Onze
n n n n n Pour un type mixte, contusion-hématome, sont caractéristiques : - les éruptions pétéchiales et les contusions qui apparaissent avant les hématomes ; - les hématomes dans le tissu rétropéritonéal et sous-cutané sont généralement peu nombreux, mais de grande taille, il n'y a pratiquement pas d'hémorragies dans les articulations et leur déformation. Le type vasculo-violet se caractérise par : - des éruptions cutanées hémorragiques, le plus souvent symétriques ; les éléments de l'éruption sont limités, légèrement surélevés au-dessus de la peau, leur apparition est souvent précédée de cloques ou de vésicules, qui sont alors trempées de sang ; les éléments hémorragiques peuvent fusionner, l'épiderme au-dessus d'eux se nécrose avec formation d'une croûte; après la disparition de l'éruption cutanée, les foyers de pigmentation de la peau restent; - saignement des organes internes - gastro-intestinal, rénal. Le type angiomateux se caractérise par: - des saignements persistants et répétés d'une ou deux, moins souvent plus de localisations (par exemple nasale, pulmonaire); - l'absence d'hémorragies spontanées et post-traumatiques au niveau de la peau, du tissu sous-cutané. Onze

 Voie interne Surface de contact Facteur tissulaire externe XII DIU VII XI XII IX fibrine insoluble Xa Va Phospholipides Ca² Prothrombinase XIII Fibrine soluble Prothrombine Thrombine Fibrinogène Monomère de fibrine 13
Voie interne Surface de contact Facteur tissulaire externe XII DIU VII XI XII IX fibrine insoluble Xa Va Phospholipides Ca² Prothrombinase XIII Fibrine soluble Prothrombine Thrombine Fibrinogène Monomère de fibrine 13
 Modélisation des voies d'hémostase Voie interne : n Temps de céphaline activée (APTT). Chemin externe : n Temps de Quick (1935, Quick). FV-mw 330 000, FVIImw 50 000, FX-mw 58 800 et FII Tests indicatifs : temps de Quick (TP) ; APTT; temps de thrombine ; Quantification du fibrinogène 14
Modélisation des voies d'hémostase Voie interne : n Temps de céphaline activée (APTT). Chemin externe : n Temps de Quick (1935, Quick). FV-mw 330 000, FVIImw 50 000, FX-mw 58 800 et FII Tests indicatifs : temps de Quick (TP) ; APTT; temps de thrombine ; Quantification du fibrinogène 14
 Indice de prothrombine - déterminé en présence d'ions calcium et d'un excès de thromboplastine tissulaire La formation de caillots dépend uniquement de l'activité du complexe prothrombine (facteurs : II, V, VII et X) Activité prothrombine selon Quick 0, 1 ml de plasma + 60 s Indice de prothrombine : ratio donneur/patient 100% 0,2 ml TCS * * - mélange thrombine-calcium 15
Indice de prothrombine - déterminé en présence d'ions calcium et d'un excès de thromboplastine tissulaire La formation de caillots dépend uniquement de l'activité du complexe prothrombine (facteurs : II, V, VII et X) Activité prothrombine selon Quick 0, 1 ml de plasma + 60 s Indice de prothrombine : ratio donneur/patient 100% 0,2 ml TCS * * - mélange thrombine-calcium 15
 Interprétation des résultats Raison de l'allongement du TP : n Administration d'anticoagulants oraux ; n Maladie du foie ; n Carence en vitamine K ; n moteur à combustion interne ; n Déficit héréditaire en prothrombine, f. VII, X ou V. Un raccourcissement du TP est observé dans la thrombose 16
Interprétation des résultats Raison de l'allongement du TP : n Administration d'anticoagulants oraux ; n Maladie du foie ; n Carence en vitamine K ; n moteur à combustion interne ; n Déficit héréditaire en prothrombine, f. VII, X ou V. Un raccourcissement du TP est observé dans la thrombose 16
 APTT - caractérise la voie interne de l'hémostase (1953) : Facteurs VIII, IX, XII ; n Prékallikriine (facteur Fletcher) n Kininogène de haut poids moléculaire (Fitzgerald f) Le test est sensible au déficit de tous les facteurs de la coagulation sanguine, à l'exception du VII, de l'héparine aux inhibiteurs spécifiques et non spécifiques. n 0, 1 plasma + 0, 1 arylide / kaolin 3 min + 0, 1 Chlorure de calcium 17
APTT - caractérise la voie interne de l'hémostase (1953) : Facteurs VIII, IX, XII ; n Prékallikriine (facteur Fletcher) n Kininogène de haut poids moléculaire (Fitzgerald f) Le test est sensible au déficit de tous les facteurs de la coagulation sanguine, à l'exception du VII, de l'héparine aux inhibiteurs spécifiques et non spécifiques. n 0, 1 plasma + 0, 1 arylide / kaolin 3 min + 0, 1 Chlorure de calcium 17
 Interprétation des résultats Cause de l'allongement de l'APTT : Déficit en facteurs de la voie interne de la coagulation ; Présence d'inhibiteurs de coagulation ; Maladie du foie; Carence en vitamine K ; LA GLACE; Administration d'héparine. Un raccourcissement est noté avec une thrombose et une CIVD 18
Interprétation des résultats Cause de l'allongement de l'APTT : Déficit en facteurs de la voie interne de la coagulation ; Présence d'inhibiteurs de coagulation ; Maladie du foie; Carence en vitamine K ; LA GLACE; Administration d'héparine. Un raccourcissement est noté avec une thrombose et une CIVD 18
 Hémophilie A, B, C. L'hémophilie est une coagulopathie congénitale caractérisée par un déficit en facteurs : n VIII (hémophilie A) n IX (hémophilie B, maladie de Christmas) n XI (hémophilie C). 19
Hémophilie A, B, C. L'hémophilie est une coagulopathie congénitale caractérisée par un déficit en facteurs : n VIII (hémophilie A) n IX (hémophilie B, maladie de Christmas) n XI (hémophilie C). 19
 L'hémophilie est une maladie caractérisée par un déficit quantitatif ou qualitatif des facteurs de coagulation VIII (hémophilie A), IX (hémophilie B) n n n Facteur VIII antihémophilique (facteur VIII) MV 270 000 - 340 000 est synthétisé par les cellules endothéliales hépatiques ? VIII : C est associé dans le plasma au facteur von Willebrand FVIII - concentration normale de la voie interne environ 0,5 g/ml nnn Le facteur IX (facteur de Noël) MB 72 000 est synthétisé dans le foie thermiquement labile et stable pendant le stockage concentration normale vitamine K dépendante 3 µg/ml 20
L'hémophilie est une maladie caractérisée par un déficit quantitatif ou qualitatif des facteurs de coagulation VIII (hémophilie A), IX (hémophilie B) n n n Facteur VIII antihémophilique (facteur VIII) MV 270 000 - 340 000 est synthétisé par les cellules endothéliales hépatiques ? VIII : C est associé dans le plasma au facteur von Willebrand FVIII - concentration normale de la voie interne environ 0,5 g/ml nnn Le facteur IX (facteur de Noël) MB 72 000 est synthétisé dans le foie thermiquement labile et stable pendant le stockage concentration normale vitamine K dépendante 3 µg/ml 20
 L'histoire de l'hémophilie est enracinée dans un passé lointain La première mention de l'hémophilie est contenue dans le Talmud de Babylone (il y a 1500 ans) Le terme - hémophilie est apparu en 1823 21
L'histoire de l'hémophilie est enracinée dans un passé lointain La première mention de l'hémophilie est contenue dans le Talmud de Babylone (il y a 1500 ans) Le terme - hémophilie est apparu en 1823 21
 Etiopathogenèse. n L'hémophilie A est de 80 % n L'hémophilie B est de 19 % n L'hémophilie C est de 1 % Les hémophilies A et B sont transmises de manière récessive, liées au chromosome X. La plupart des hommes sont malades, les femmes sont porteuses du gène et la moitié de leurs fils peuvent souffrir d'hémophilie. L'hémophilie C se transmet de manière autosomique récessive, de sorte que les personnes des deux sexes tombent malades avec la même fréquence. 22
Etiopathogenèse. n L'hémophilie A est de 80 % n L'hémophilie B est de 19 % n L'hémophilie C est de 1 % Les hémophilies A et B sont transmises de manière récessive, liées au chromosome X. La plupart des hommes sont malades, les femmes sont porteuses du gène et la moitié de leurs fils peuvent souffrir d'hémophilie. L'hémophilie C se transmet de manière autosomique récessive, de sorte que les personnes des deux sexes tombent malades avec la même fréquence. 22
 épouses N R F 1 h X X N N X X, H h XX, en bonne santé. porte. mari. --H X Y, bien. n X Y h XY patient 23
épouses N R F 1 h X X N N X X, H h XX, en bonne santé. porte. mari. --H X Y, bien. n X Y h XY patient 23

 25
25
 La population de la Russie et le nombre estimé de patients atteints d'hémophilie 6 764 67 645 000 77 654 000 Selon le Comité national des statistiques, les résultats du recensement de la population panrusse de 2002 Le pays abrite 145 millions 290 000 personnes 26
La population de la Russie et le nombre estimé de patients atteints d'hémophilie 6 764 67 645 000 77 654 000 Selon le Comité national des statistiques, les résultats du recensement de la population panrusse de 2002 Le pays abrite 145 millions 290 000 personnes 26
 La gravité des saignements dépend du degré de déficit en facteur. Normalement, il est de 50 à 100 % Forme latente n Avec une diminution à 20 à 50 %, il y a une tendance à l'augmentation des saignements avec des blessures importantes Forme sévère n À un niveau de facteur de 5 à 20 %, des saignements sévères surviennent avec des blessures Forme sévère n S'il oscille entre 1 et 5 %, il se produit une hémorragie spontanée Forme très sévère n Absence totale de facteur. n 27
La gravité des saignements dépend du degré de déficit en facteur. Normalement, il est de 50 à 100 % Forme latente n Avec une diminution à 20 à 50 %, il y a une tendance à l'augmentation des saignements avec des blessures importantes Forme sévère n À un niveau de facteur de 5 à 20 %, des saignements sévères surviennent avec des blessures Forme sévère n S'il oscille entre 1 et 5 %, il se produit une hémorragie spontanée Forme très sévère n Absence totale de facteur. n 27
 Clinique. Des saignements accrus apparaissent dès les premiers mois de la vie d'un enfant n Les saignements apparaissent dans le contexte des blessures : coupures, ecchymoses, divers accommodements n Des hémorragies profondes surviennent, des saignements abondants au site de la blessure, des hémorragies dans les grosses articulations développement de contracture et d'ankylose des articulations (souvent genou et cheville), dangereux hématomes massifs intermusculaires, sous-fasciaux, rétropéritonéaux, humaturie. n 28
Clinique. Des saignements accrus apparaissent dès les premiers mois de la vie d'un enfant n Les saignements apparaissent dans le contexte des blessures : coupures, ecchymoses, divers accommodements n Des hémorragies profondes surviennent, des saignements abondants au site de la blessure, des hémorragies dans les grosses articulations développement de contracture et d'ankylose des articulations (souvent genou et cheville), dangereux hématomes massifs intermusculaires, sous-fasciaux, rétropéritonéaux, humaturie. n 28

 30
30
 31
31
 32
32
 33
33
 34
34
 Diagnostique. 1. n n 2. 3. Coagulogramme : Diminution du temps de coagulation sanguine Augmentation du temps de thromboplastine partielle active Diminution de l'autocoagulation, de l'activité de coagulation Prothrombine, le temps de thrombine est normal. Diminution du niveau et de l'activité des facteurs VIII, IX, XI Test immunologique pour la détermination de l'antigène des facteurs à l'aide d'anticorps-inhibiteurs homologues. 35
Diagnostique. 1. n n 2. 3. Coagulogramme : Diminution du temps de coagulation sanguine Augmentation du temps de thromboplastine partielle active Diminution de l'autocoagulation, de l'activité de coagulation Prothrombine, le temps de thrombine est normal. Diminution du niveau et de l'activité des facteurs VIII, IX, XI Test immunologique pour la détermination de l'antigène des facteurs à l'aide d'anticorps-inhibiteurs homologues. 35


 Qu'est-ce que l'activité du facteur VIII ? Mesuré en unités internationales dans une bouteille (250 UI, 500 UI, 1000 UI); n En 1 ml. le plasma normal contient 1 UI de facteur VIII; n 1 UI de facteur VIII administré par kg. le poids corporel augmente les niveaux de facteur VIII d'environ 2 %. n 38
Qu'est-ce que l'activité du facteur VIII ? Mesuré en unités internationales dans une bouteille (250 UI, 500 UI, 1000 UI); n En 1 ml. le plasma normal contient 1 UI de facteur VIII; n 1 UI de facteur VIII administré par kg. le poids corporel augmente les niveaux de facteur VIII d'environ 2 %. n 38
 Dose thérapeutique : Hémophilie A - 25-50 UI/kg toutes les 12 heures ; n Hémophilie B - 25-50 UI/kg toutes les 24 heures ; n 39
Dose thérapeutique : Hémophilie A - 25-50 UI/kg toutes les 12 heures ; n Hémophilie B - 25-50 UI/kg toutes les 24 heures ; n 39
 Le traitement substitutif par les facteurs de coagulation VIII ou IX est effectué par le patient lui-même ou sur le fait d'une hémorragie ou à des fins prophylactiques. 40
Le traitement substitutif par les facteurs de coagulation VIII ou IX est effectué par le patient lui-même ou sur le fait d'une hémorragie ou à des fins prophylactiques. 40
 Traitement. FFP contenant les facteurs VIII, IX, XI 2. Cryoprécipité (environ 100 unités dans 1 portion) 3. Plasma antihémophilique (concentré de facteurs VIII, IX), agemphil A, B Thérapie locale : 1. Minimisation de la douleur, suture, glace 2. En hémarthrose - immobilisation, glace, position surélevée Thérapie générale : 1. Epsilon - acide aminocaproïque, progestatifs synthétiques Traitement de l'anémie : transfusion d'érythie. masses. 1,41
Traitement. FFP contenant les facteurs VIII, IX, XI 2. Cryoprécipité (environ 100 unités dans 1 portion) 3. Plasma antihémophilique (concentré de facteurs VIII, IX), agemphil A, B Thérapie locale : 1. Minimisation de la douleur, suture, glace 2. En hémarthrose - immobilisation, glace, position surélevée Thérapie générale : 1. Epsilon - acide aminocaproïque, progestatifs synthétiques Traitement de l'anémie : transfusion d'érythie. masses. 1,41

 Etiopathogenèse du PTI. La principale cause de saignement est la thrombocytopénie. Causes de la thrombocytopénie : 1. L'effet inhibiteur de la rate sur la formation des plaquettes - des mégacaryocytes inactifs se trouvent dans le ponctuation de la moelle osseuse. n 43
Etiopathogenèse du PTI. La principale cause de saignement est la thrombocytopénie. Causes de la thrombocytopénie : 1. L'effet inhibiteur de la rate sur la formation des plaquettes - des mégacaryocytes inactifs se trouvent dans le ponctuation de la moelle osseuse. n 43
 2. Destruction accélérée des plaquettes dans la rate - la durée de vie des plaquettes est de plusieurs heures au lieu de 7 à 10 jours 3. Dans les thrombocytopénies héréditaires, les défauts de la structure membranaire, la perturbation des processus énergétiques entraînent une destruction rapide 4. Avec l'ITP acquis, des anticorps antiplaquettaires sont produits dans la rate. Ig. G.44
2. Destruction accélérée des plaquettes dans la rate - la durée de vie des plaquettes est de plusieurs heures au lieu de 7 à 10 jours 3. Dans les thrombocytopénies héréditaires, les défauts de la structure membranaire, la perturbation des processus énergétiques entraînent une destruction rapide 4. Avec l'ITP acquis, des anticorps antiplaquettaires sont produits dans la rate. Ig. G.44
 Evolution de la maladie : n Chronique, récurrente n Aiguë (hapténique) L'infection virale ou certains médicaments (sulfonamides, butadione, quinine) jouent le rôle d'un haptène associé aux plaquettes. Les anticorps résultants provoquent la destruction des plaquettes et l'apparition de saignements accrus. 45
Evolution de la maladie : n Chronique, récurrente n Aiguë (hapténique) L'infection virale ou certains médicaments (sulfonamides, butadione, quinine) jouent le rôle d'un haptène associé aux plaquettes. Les anticorps résultants provoquent la destruction des plaquettes et l'apparition de saignements accrus. 45
 Clinique ITP. n Le tableau clinique se manifeste lorsque la numération plaquettaire est inférieure à 100 x 10 * 9 / l. Avec une numération plaquettaire inférieure à 50 x 10 * 9 / l, des saignements potentiellement mortels peuvent survenir. ... 46
Clinique ITP. n Le tableau clinique se manifeste lorsque la numération plaquettaire est inférieure à 100 x 10 * 9 / l. Avec une numération plaquettaire inférieure à 50 x 10 * 9 / l, des saignements potentiellement mortels peuvent survenir. ... 46
 Petites hémorragies sous-cutanées ponctuées - pétéchies, ecchymoses, localisées de manière asymétrique n Saignements des muqueuses : gingivales, saignements de nez n Saignements du tractus gastro-intestinal n Hématurie n Hémoptysie n Hémorragies aux sites d'injection n Saignements prolongés après extraction dentaire n Anémie post-hémorragique. n 47
Petites hémorragies sous-cutanées ponctuées - pétéchies, ecchymoses, localisées de manière asymétrique n Saignements des muqueuses : gingivales, saignements de nez n Saignements du tractus gastro-intestinal n Hématurie n Hémoptysie n Hémorragies aux sites d'injection n Saignements prolongés après extraction dentaire n Anémie post-hémorragique. n 47
 48
48
 49
49
 Diagnostic du PTI. n n n Formule sanguine complète : Diminution du nombre d'érythrocytes et d'hémoglobine Diminution du nombre de plaquettes (inférieur à 100 x10*9/l) Avec un processus auto-immun, augmentation de la VS Modifications morphologiques des plaquettes : augmentation de la taille. 50
Diagnostic du PTI. n n n Formule sanguine complète : Diminution du nombre d'érythrocytes et d'hémoglobine Diminution du nombre de plaquettes (inférieur à 100 x10*9/l) Avec un processus auto-immun, augmentation de la VS Modifications morphologiques des plaquettes : augmentation de la taille. 50
 n Coagulogramme : augmentation des saignements selon Duke et Ivy, diminution de la rétraction, temps de coagulation sanguine et test à la kaolinkephaline normaux n Myélogramme : le nombre de mégacaryocytes est augmenté n Test de Dixon - détection des anticorps antiplaquettaires. 51
n Coagulogramme : augmentation des saignements selon Duke et Ivy, diminution de la rétraction, temps de coagulation sanguine et test à la kaolinkephaline normaux n Myélogramme : le nombre de mégacaryocytes est augmenté n Test de Dixon - détection des anticorps antiplaquettaires. 51
 52
52
 Traitement ITP. Glucocorticoïdes : prednisolone 40-60 mg/jour selon le schéma n Si le GCS est inefficace, des immunosuppresseurs sont utilisés - metipred, vincristine, azathioprine, cyclophosphamide n Splénectomie Indications : anémie croissante, inefficacité des médicaments. ... n 53
Traitement ITP. Glucocorticoïdes : prednisolone 40-60 mg/jour selon le schéma n Si le GCS est inefficace, des immunosuppresseurs sont utilisés - metipred, vincristine, azathioprine, cyclophosphamide n Splénectomie Indications : anémie croissante, inefficacité des médicaments. ... n 53
 n Les thrombocytopathies sont des maladies dans lesquelles la qualité et les propriétés fonctionnelles sont altérées - adhérence et agrégation des plaquettes, entraînant une altération de l'hémostase. Avec les thrombocytopathies, la numération plaquettaire est dans les limites normales. n Parmi les diathèses hémorragiques survient dans 36 % des cas. 54
n Les thrombocytopathies sont des maladies dans lesquelles la qualité et les propriétés fonctionnelles sont altérées - adhérence et agrégation des plaquettes, entraînant une altération de l'hémostase. Avec les thrombocytopathies, la numération plaquettaire est dans les limites normales. n Parmi les diathèses hémorragiques survient dans 36 % des cas. 54
 Clinique de thrombocytopathie. Hémorragies sous-cutanées à taches pétéchiales, hématomes localisés asymétriquement n Saignements des muqueuses : gingivales, saignements de nez n Saignements du tractus gastro-intestinal n Hématurie n Hémoptysie n Hémorragies aux sites d'injection n Saignements prolongés après extraction dentaire n Anémie post-hémorragique. n 55
Clinique de thrombocytopathie. Hémorragies sous-cutanées à taches pétéchiales, hématomes localisés asymétriquement n Saignements des muqueuses : gingivales, saignements de nez n Saignements du tractus gastro-intestinal n Hématurie n Hémoptysie n Hémorragies aux sites d'injection n Saignements prolongés après extraction dentaire n Anémie post-hémorragique. n 55
 Diagnostique. n Analyse sanguine générale : 1. Diminution du nombre d'érythrocytes et d'hémoglobine 2. Le nombre de plaquettes est normal 3. Dans la morphologie des plaquettes, les granulomères et les processus ne sont pas déterminés. 56
Diagnostique. n Analyse sanguine générale : 1. Diminution du nombre d'érythrocytes et d'hémoglobine 2. Le nombre de plaquettes est normal 3. Dans la morphologie des plaquettes, les granulomères et les processus ne sont pas déterminés. 56
 Traitement. Régime avec vit C, P, A, consommation d'arachide n Acide aminocaproïque 6-12 g/jour n Dicinone, vicasol n PAMBA, acide tranexam n ATP, sulfate de magnésium n Riboxine, inosine-F n Androxone, adrénoxyl n Masse plaquettaire n Arrêt local du sang. n 61
Traitement. Régime avec vit C, P, A, consommation d'arachide n Acide aminocaproïque 6-12 g/jour n Dicinone, vicasol n PAMBA, acide tranexam n ATP, sulfate de magnésium n Riboxine, inosine-F n Androxone, adrénoxyl n Masse plaquettaire n Arrêt local du sang. n 61

 Pathogénèse. La vascularite hémorragique fait référence à des maladies à complexes immuns, car elle est causée par l'effet dommageable des complexes immuns (IC) de faible poids moléculaire. Lorsqu'ils se forment, on observe la prédominance de l'antigène. L'IR et le complément activé par eux provoquent une microthrombovasculite avec nécrose fibrinoïde, un œdème périvasculaire, un blocage de la microcirculation. 64
Pathogénèse. La vascularite hémorragique fait référence à des maladies à complexes immuns, car elle est causée par l'effet dommageable des complexes immuns (IC) de faible poids moléculaire. Lorsqu'ils se forment, on observe la prédominance de l'antigène. L'IR et le complément activé par eux provoquent une microthrombovasculite avec nécrose fibrinoïde, un œdème périvasculaire, un blocage de la microcirculation. 64
 Cours clinique. L'évolution clinique se distingue : n Peau ou forme simple n Forme articulaire n Forme abdominale n Forme rénale n Forme fulminante Au cours de la maladie on distingue : 1. Aigu 2. Chronique, récurrent. 65
Cours clinique. L'évolution clinique se distingue : n Peau ou forme simple n Forme articulaire n Forme abdominale n Forme rénale n Forme fulminante Au cours de la maladie on distingue : 1. Aigu 2. Chronique, récurrent. 65
 Clinique. n Forme cutanée Les lésions cutanées sont des pétéchies symétriques à petites pointes, principalement sur les membres inférieurs et les fesses. L'éruption est monomorphe, avec une base inflammatoire distincte, dure 4 à 5 jours, laissant une pigmentation derrière elle. 66
Clinique. n Forme cutanée Les lésions cutanées sont des pétéchies symétriques à petites pointes, principalement sur les membres inférieurs et les fesses. L'éruption est monomorphe, avec une base inflammatoire distincte, dure 4 à 5 jours, laissant une pigmentation derrière elle. 66
 n Forme articulaire n Le siège des lésions articulaires est la synoviale. n Il y a une douleur aiguë, un gonflement, un dysfonctionnement de l'articulation. n Forme abdominale Des hémorragies surviennent dans la membrane muqueuse de l'estomac, des intestins, du mésentère. Surgir douleur sévère dans l'abdomen, simulant l'image d'un abdomen aigu, la température corporelle peut augmenter, parfois des vomissements apparaissent. Dans les selles, le sang est déterminé. 67
n Forme articulaire n Le siège des lésions articulaires est la synoviale. n Il y a une douleur aiguë, un gonflement, un dysfonctionnement de l'articulation. n Forme abdominale Des hémorragies surviennent dans la membrane muqueuse de l'estomac, des intestins, du mésentère. Surgir douleur sévère dans l'abdomen, simulant l'image d'un abdomen aigu, la température corporelle peut augmenter, parfois des vomissements apparaissent. Dans les selles, le sang est déterminé. 67
 n Forme rénale n Elle évolue comme une néphrite aiguë ou chronique, prend parfois une forme prolongée et se transforme en insuffisance rénale chronique. Le développement est possible hypertension artérielle, syndrome néphrotique n Forme fulminante (cérébrale) Elle se développe avec une hémorragie dans la muqueuse du cerveau ou des zones vitales. 68
n Forme rénale n Elle évolue comme une néphrite aiguë ou chronique, prend parfois une forme prolongée et se transforme en insuffisance rénale chronique. Le développement est possible hypertension artérielle, syndrome néphrotique n Forme fulminante (cérébrale) Elle se développe avec une hémorragie dans la muqueuse du cerveau ou des zones vitales. 68
 Diagnostique. n Manifestations cliniques : éruptions monomorphes, ponctuelles, symétriques qui ne disparaissent pas à la pression n Hyperfibrinogénémie, augmentation du contenu en IC, cryoglobulines, gamma globulines n Test d'autocoagulation positif n Sur un coagulogramme, un raccourcissement du temps total de coagulation sanguine, prothrombine et temps de thrombine. 69
Diagnostique. n Manifestations cliniques : éruptions monomorphes, ponctuelles, symétriques qui ne disparaissent pas à la pression n Hyperfibrinogénémie, augmentation du contenu en IC, cryoglobulines, gamma globulines n Test d'autocoagulation positif n Sur un coagulogramme, un raccourcissement du temps total de coagulation sanguine, prothrombine et temps de thrombine. 69
 Traitement : Héparine 7 500-15 000 U/jour IV ou SC sous contrôle de la coagulation sanguine n Héparinoïdes : sulodexide, lomaparan n Plasmaphérèse étagée n Hormones stéroïdes : prednisolone 20-60 mg/jour selon le schéma n Amélioration de la microcirculation : trental, pentoxifylline n Renforcement de la paroi vasculaire : acide ascorbique, rutine. n 70
Traitement : Héparine 7 500-15 000 U/jour IV ou SC sous contrôle de la coagulation sanguine n Héparinoïdes : sulodexide, lomaparan n Plasmaphérèse étagée n Hormones stéroïdes : prednisolone 20-60 mg/jour selon le schéma n Amélioration de la microcirculation : trental, pentoxifylline n Renforcement de la paroi vasculaire : acide ascorbique, rutine. n 70
Chapitre 40
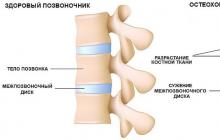
MALADIES ET SYNDROMES HEMORRAGIQUES (DIATHESE)
La diathèse hémorragique est le nom général des affections caractérisées par une tendance accrue du corps à saigner. Parmi les causes d'augmentation des saignements figurent:
Violations de la paroi vasculaire - télangiectasie héréditaire de Randu-Osler, vascularite hémorragique ou purpura de Shen-lain-Henoch;
Pathologie plaquettaire - Thrombocytopénie de Werlhof;
Troubles du système de coagulation du plasma sanguin - hémophilie;
Le syndrome thrombohémorragique est un syndrome de coagulation intravasculaire disséminée qui complique l'évolution de nombreuses maladies graves.
TÉLÉANGIEKTASY HÉMORRAGIQUE HÉRÉDITAIRE
La télangiectasie hémorragique héréditaire (maladie de Randu-Osler) est une maladie héréditaire caractérisée par un syndrome hémorragique causé par de multiples télangiectasies sur la peau et les muqueuses. La transmission de la maladie se fait sur le mode autosomique dominant.
Étiologie et pathogenèse
Le saignement dans la maladie de Randu-Osler est causé par un développement insuffisant du squelette sous-endothélial des petits vaisseaux et une infériorité de l'endothélium dans certaines zones du lit vasculaire. L'insuffisance des tissus mésenchymateux peut se manifester par une augmentation de l'élasticité de la peau, une faiblesse de l'appareil ligamentaire (prolapsus valvulaire, luxations habituelles). Les télangiectasies commencent à se former dans l'enfance, vers l'âge de 8-10 ans et deviennent visibles vers l'âge de 20 ans environ sur les muqueuses du nez, des lèvres, des gencives, des joues,
cuir chevelu. Les télangiectasies peuvent être irrégulières, d'abord sous la forme de petites taches, puis sous la forme de nodules rouge vif de 5 à 7 mm de diamètre, qui disparaissent lorsqu'ils sont pressés.
Manifestations cliniques
Les principales manifestations cliniques de la maladie sont des saignements de la cavité nasale, moins souvent du tractus gastro-intestinal, des poumons (hémoptysie). Des saignements répétés entraînent déficience en fer... Avec la formation de shunts artérioveineux, un essoufflement, une cyanose, une érythrocytose hypoxique apparaissent.
Méthodes de recherche instrumentale
Le diagnostic de la maladie ne fait aucun doute en présence d'antécédents familiaux et de télangiectasies visibles, y compris sur les muqueuses, qui sont révélées lors d'un examen particulier du patient (bronchoscopie, FEGDS).
Traitement
Le traitement consiste à arrêter le saignement, pour lequel un traitement hémostatique est utilisé. Si l'action locale est impossible, une coagulation des zones de saignement de la membrane muqueuse est effectuée.
VASCULITE HÉMORRAGIQUE
La vascularite hémorragique (purpura de Schenlein-Henoch) est une vascularite hyperergique, un type de purpura vasculaire systémique, caractérisé par le dépôt de complexes immuns (contenant souvent des IgA) dans les parois des petits vaisseaux avec des éruptions hémorragiques symétriques caractéristiques, de l'arthrite, un syndrome abdominal et une glomérulonéphrite. La maladie survient généralement à un jeune âge, souvent après des infections aiguës, une hypothermie, avec réactions allergiques au médicaments, nourriture, alcool. Dans certains cas, la cause de la vascularite hémorragique peut être une infection chronique par les virus de l'hépatite B et C, une tumeur système lymphatique, la collagénose.
Manifestations cliniques
Apparition aiguë avec une augmentation de la température corporelle, augmentant les symptômes d'intoxication.
Syndrome hémorragique cutané : pétéchies et purpura apparaissent sur la peau des faces extenseurs des membres inférieurs (Fig. 45, voir encart couleur).
Syndrome articulaire : les atteintes articulaires se manifestent par des arthralgies, moins souvent par des arthrites bénignes.
Syndrome abdominal : parfois la principale manifestation clinique peut être des lésions vasculaires cavité abdominale avec des douleurs aiguës et des saignements du tractus gastro-intestinal.
Le syndrome rénal se manifeste par le développement d'une glomérulonéphrite, plus souvent hématurique, moins souvent avec syndrome néphrotique. Il peut y avoir une variante rapidement progressive de la glomérulonéphrite avec le développement d'une insuffisance rénale chronique.
Traitement est de traiter la maladie sous-jacente. Dans la forme primaire de la maladie, une plasmaphérèse, des anticoagulants, des agents antiplaquettaires sont prescrits. Lors du traitement lors d'une exacerbation, un régime de demi-lit est nécessaire. Des agents désensibilisants sont utilisés. Avec le syndrome abdominal, la prednisolone est prescrite. La plasmaphérèse peut être utilisée.
Prévision dépend de la rapidité d'évolution de la glomérulonéphrite chronique avec hématurie et de la progression de l'insuffisance rénale.
VIOLET THROMBOCYTOPÉNIQUE IDIOPATHIQUE
Le purpura thrombocytopénique (maladie de Werlhof) est une maladie causée par la formation d'anticorps antiplaquettaires et caractérisée par une thrombocytopénie. Le purpura thrombocytopénique survient le plus souvent chez les jeunes. Le développement du purpura thrombocytopénique idiopathique peut être déclenché par une maladie respiratoire aiguë ou la prise de médicaments.
Manifestations cliniques
Dans la maladie de Verlhof, les principaux signes cliniques et biologiques sont :
Purpura - petites éruptions cutanées hémorragiques sur la peau des mains, de la poitrine, du cou, parfois sur les muqueuses. Il y a peut-être
l'apparition d'hémorragies sous-cutanées étendues ou de saignements sévères de la cavité nasale, du tractus gastro-intestinal, de la cavité utérine, des saignements intracrâniens;
la rate est hypertrophiée, mais généralement pas détectée par palpation ;
augmentation du temps de coagulation du sang, altération de la rétraction du caillot sanguin. Une hémorragie spontanée survient lorsque la numération plaquettaire est de 20 à 10 × 10 9 / l. V moelle le nombre de mégacaryocytes est généralement normal ou augmenté.
Traitement
Les glucocorticoïdes, en cas d'inefficacité, une association avec des cytostatiques est possible. Avec inefficacité thérapie médicamenteuse une splénectomie est montrée.
AUTRES TYPES DE THROMBOCYTOPENIE
Il existe des thrombocytopénies secondaires (symptomatiques) qui peuvent survenir avec une anémie aplasique ou mégaloblastique, une myélofibrose, une leucémie, un LED, infection virale, métastases d'une tumeur maligne dans la moelle osseuse, sous l'influence d'un rayonnement radioactif, de médicaments (indométacine, butadion, sulfamides, cytostatiques). Une augmentation de la dégradation des plaquettes avec thrombocytopénie est observée dans le syndrome DV, l'implantation de valves cardiaques prothétiques, le purpura thrombocytopénique thrombotique.
Hémophilie
L'hémophilie est une coagulopathie causée par un déficit en facteurs de coagulation sanguine : VIII dans l'hémophilie A et IX dans l'hémophilie B, qui entraîne une augmentation du temps de coagulation du sang total. L'hémophilie désigne les maladies héréditaires dont seuls les hommes souffrent, la mère du patient étant porteuse du gène défectueux. L'hémophilie est héréditaire selon un schéma récessif lié au sexe.
Manifestations cliniques
Un saignement prolongé est caractéristique, même avec des dommages mécaniques mineurs. De légers bleus peuvent entraîner des hémorragies étendues, en particulier une hémarthrose (accumulation de sang dans
cavité articulaire) avec son ankylose ultérieure. Des saignements nasaux, gastro-intestinaux, rénaux sont possibles. Le saignement de type hématome est caractéristique de l'hémophilie. Des hématomes intermusculaires, intramusculaires, sous-périostés et rétropéritonéaux peuvent se développer, entraînant la destruction des tissus environnants.
Diagnostic de laboratoire
Augmentation du temps de coagulation du sang aux valeurs normales de l'indice de prothrombine et des tests de thrombine.
Diminution de l'activité des facteurs de coagulation sanguine VIII et IX (dans les cas graves, jusqu'à 0-20 U/L).
Traitement
Pendant de nombreuses années, le traitement principal a été l'administration de plasma frais congelé, qui est connu pour contenir divers facteurs de coagulation. Actuellement, les cryoprécipités ou concentrés de facteur VIII (pour l'hémophilie A) ou de facteur IX (pour l'hémophilie B) sont sélectivement utilisés.
MANIFESTATIONS DENTAIRES
POUR LES MALADIES DU SANG
Au cours de l'embryogenèse, la muqueuse buccale, qui apparaît dans l'embryon au 12e jour, joue le rôle d'organe hématopoïétique. Dans les périodes ultérieures de développement de l'embryon et du fœtus, la fonction de l'hématopoïèse est successivement assumée par le foie, la rate, la moelle osseuse. Cependant, tout au long de la vie, la muqueuse buccale communique avec les organes hématopoïétiques. Ceci est confirmé par la prolifération d'infiltrats leucémiques principalement dans les tissus du mésoderme et, en particulier, sur la muqueuse buccale. Particulièrement clairement, souvent au début de la maladie, les maladies du sang se manifestent par des modifications prononcées de la membrane muqueuse, du parodonte et des tissus dentaires. Le premier rapport de lésions buccales en Leucémie aiguë appartient à Ebstein (1889), qui a décrit une pâleur, un relâchement, un saignement de la membrane muqueuse, un retard des gencives par rapport aux dents. Plus tard, de nombreux chercheurs ont souligné la similitude des modifications de la cavité buccale avec une forme sévère de scorbut : pâleur et gonflement de la muqueuse buccale, du bord gingival, en particulier des papilles interdentaires, qui peuvent également être sombres.
mais de couleur rouge, saignent facilement, les dents sont lâches, "enfouies dans les gencives". La stomatite ulcéreuse et/ou la gingivite évoluent rapidement. Les hémorragies des muqueuses et les saignements des gencives sont souvent le premier symptôme de la leucémie. Les lésions destructrices de la muqueuse buccale occupent la 2ème place en fréquence après les manifestations hémorragiques chez ces patients. En termes de profondeur, les processus destructeurs sont divisés en superficiels et profonds. Avec les lésions superficielles, on observe une érosion « étalée » à bords irréguliers ou aphtes arrondis avec ou sans corolle d'hyperémie, recouverte d'une fine plaque non amovible. On pense que la stomatite érosive et aphteuse superficielle est caractéristique de la leucémie myéloïde. Chez les patients atteints de leucémie peu différenciée, qui ont une évolution maligne, déjà au début de la maladie sur la membrane muqueuse des joues le long de la ligne de fermeture et sur les surfaces latérales de la langue, des zones de nécrose avec une légère réaction inflammatoire de les tissus environnants sont révélés. Des processus hémorragiques et ulcéros-nécrotiques se développent souvent sur fond d'hypertrophie gingivale, ce qui a fait évoquer le terme de "stomatite leucémique". La base pathogénique de ces changements, ainsi que l'immunosuppression systémique, la thrombocytopénie et l'anémie, sont des processus spécifiques de la muqueuse buccale associés à sa dystrophie et à sa métaplasie, qui réduisent fortement la résistance de la membrane muqueuse à divers facteurs. Chez les patients atteints de leucémie, on détecte souvent des lésions fongiques de la muqueuse buccale, l'apparition d'éruptions herpétiques, qui sont associées, d'une part, à des lésions du système réticulohistiocytaire par un processus leucémique, et d'autre part, à l'effet de thérapie cytostatique de base.
Des modifications très caractéristiques de la muqueuse buccale sont détectées chez les patients anémiques. Il convient de noter que souvent ces patients consultent d'abord le dentiste en raison de plaintes de sécheresse de la bouche, de convulsions aux coins de la bouche, de saignements des gencives, plus souvent lors du brossage des dents ou de la morsure d'aliments solides, sensation de brûlure, picotements, picotements ou gonflement de la langue. Une étude objective révèle des signes d'atrophie de l'épithélium tégumentaire, qui se manifeste par une pâleur, un amincissement, une perte d'élasticité de la membrane muqueuse. La membrane muqueuse est légèrement humidifiée et sèche rapidement lorsque l'on parle. Aux endroits où il s'étire le plus, des fissures très douloureuses avec un écoulement maigre apparaissent - le phénomène de "stomatite angulaire". L'atrophie des papilles de la langue donne une image de glossite atrophique - une langue lisse et polie, généralement avec un processus continu à long terme. La raison de l'apparition
Pour les changements spécifiques de la langue, ainsi que la carence en fer, un manque de vitamines du groupe B est envisagé.Les troubles trophiques de la muqueuse buccale sont considérés comme les symptômes les plus graves et les plus défavorables sur le plan pronostique de l'anémie ferriprive. En plus des dommages causés à la membrane muqueuse chez les patients souffrant d'anémie ferriprive, les tissus de la dent et du parodonte en souffrent. Presque tous les patients atteints d'anémie ont des caries - l'indice d'intensité de la carie dentaire est de 11,8 et, chez certains patients, de plus de 20,0. L'évolution clinique de la carie présente des particularités : elle est indolore et se remarque soit par un défaut esthétique, soit par des aliments coincés dans la cavité de la dent ou entre les dents, soit par l'apparition de gonflements ou de fistules au niveau de la dent affectée.
L'anémie pernicieuse (carence en vitamine B 12) est actuellement rencontrée assez souvent et a des manifestations spécifiques de la cavité buccale. Tout d'abord, ces changements sont dus à des symptômes neurologiques - douleur, brûlure, picotements, picotements de la langue, qui peuvent être de nature insupportable et sont associés à une violation du goût. La membrane muqueuse à l'examen est pâle, des éruptions pétéchiales sont souvent observées, dans les formes sévères d'anémie - ecchymoses, zones de pigmentation. L'atrophie de l'épithélium et des papilles de la langue, caractéristiques des patients atteints d'anémie par déficit en B 12, a permis de donner un nom spécifique "glossite de Genter-Möller" (langue de "Hunter"). Il est assez caractéristique que ces patients n'aient jamais de plaque sur la langue.
- Diathèse hémorragique causée par une altération de la thrombocytopoïèse ou de l'hémostase plaquettaire (thrombocytopathie).
- Purpura thrombocytopénique (idiopathique et acquis).
- Thrombocytopénie symptomatique (leucémie, aleucie hémorragique, mal des rayons, etc.).
- Thrombocytopathie (troubles de l'agrégation-adhésive et d'autres fonctions des plaquettes).
- Thrombocytémie hémorragique.
- Diathèse hémorragique causée par une coagulation sanguine altérée et une fibrinolyse ou une hémostase de la coagulation (coagulopathie).
- Violation de la formation de thromboplastine, ou la 1ère phase de la coagulation sanguine.
- Hémophilie A, B et C.
- Violation de la formation de thrombine, ou 2e phase de la coagulation sanguine (dysprothrombie).
- Hypoproaccélérinémie (parahémophilie).
- Hypoproconvertinémie.
- Déficit en facteur X (Stuart-Prower).
Hypoprothrombinémie (diathèse hémorragique des nouveau-nés ; avitaminose K endogène avec ictère obstructif ; lésions hépatiques ; diathèse hémorragique médicamenteuse ou dicumaria après une surdose d'anticoagulants indirects). Violation de la formation de thrombine (diathèse hémorragique médicamenteuse après un surdosage d'anticoagulants directs tels que l'héparine).
- Violation de la formation de fibrine, ou 3ème phase de la coagulation sanguine.
Purpura afibrinogénique (congénital). Fibrinogénopathies (hypofibrinogénémie acquise). Absence de facteur de stabilisation de la fibrine (XIII).
- Violation de la fibrinolyse.
Saignements et hémorragies fibrinolytiques dus à une fibrinolyse aiguë due à un syndrome thrombohémorragique (syndrome de coagulation intravasculaire disséminée, coagulopathie de consommation) et à un surdosage de médicaments thrombolytiques.
- Perturbation de la coagulation sanguine en différentes phases, provoquée par les anticoagulants circulants (antithromboplastines, inhibiteurs des facteurs VIII et IX, antithrombines).
III. Diathèse hémorragique causée par des dommages à la paroi vasculaire (vasopathie).
Vascularite hémorragique (maladie de Shenlein-Henoch). Purpura hémorragique associé à des effets infectieux-toxiques, infectieux-allergiques, dystrophiques et neuroendocriniens.
Angiomatose hémorragique (maladie de Randu-Osler-Weber), avitaminose C (scorbut).
Selon 3.S. Barkagan, avec diathèse hémorragique, il faut distinguer les principaux types de saignements suivants:
- Hématome. Il est caractéristique des troubles du mécanisme interne de la coagulation sanguine - héréditaires (hémophilie) et acquis (apparition d'anticoagulants circulants dans le sang). Parfois, il est observé avec un surdosage d'anticoagulants (hématomes rétropéritonéaux).
- Capillaire ou microcirculatoire. Il est caractéristique de la thrombocytopénie et de la thrombocytopathie, ainsi que du déficit en facteurs plasmatiques du complexe prothrombique (V, VII, X, II), de l'hypo- et de la dysfibrinogénémie; se manifeste par des hémorragies cutanées tachetées de pétéchies, des muqueuses, des saignements des gencives, de l'utérus, du nez.
- Capillaire-hématome mixte. Elle est caractéristique de la coagulation intravasculaire disséminée (syndrome thrombohémorragique), de la maladie de von Willebrand (déficit en facteur VIII, facteur vasculaire et altération de la fonction d'adhésion-agrégation plaquettaire), d'un surdosage en anticoagulants. Elle se manifeste principalement par des hématomes et des hémorragies à taches pétéchiales.
- Violet. On l'observe dans les vascularites hémorragiques et autres endothélioses. Elle se manifeste principalement par de petites hémorragies ponctuées et érythémateuses localisées symétriquement.
- Microangiomateux. Elle est due à des dysplasies vasculaires héréditaires et acquises (maladie de Randu-Osler, capillaropathies symptomatiques). Elle se caractérise par des saignements répétés persistants de la même localisation.
Toutes les diathèses hémorragiques énumérées ci-dessus ne peuvent pas être attribuées à des conditions d'urgence, cependant, avec beaucoup d'entre elles, à certaines périodes, le syndrome hémorragique est si prononcé qu'un traitement urgent est nécessaire.
De telles diathèses hémorragiques le plus souvent rencontrées dans une clinique thérapeutique comprennent le purpura thrombocytopénique (un type de thrombocytopathie), l'hémophilie, la diathèse hémorragique d'origine médicamenteuse (dicumarine et héparine), les saignements fibrinolytiques et les hémorragies dans le syndrome de coagulation sanguine thrombohémorragique et le syndrome de coagulation intravasculaire (syndrome de coagulation intravasculaire ) , la vascularite hémorragique et l'angiomatose hémorragique (types de vasopathie).
Causes

Distinguer les formes héréditaires (familiales) des vivaces, en commençant par enfance les formes hémorragiques et acquises sont majoritairement secondaires (symptomatiques). La plupart des formes héréditaires sont associées à des anomalies des mégacaryocytes et des plaquettes, à un dysfonctionnement de ces derniers, ou à une déficience ou à un défaut des facteurs de coagulation plasmatiques, ainsi qu'au facteur von Willebrand, moins souvent à une infériorité des petits vaisseaux sanguins.
La plupart des formes acquises de saignement sont associées à Syndrome CIVD, lésions immunitaires et immunocomplexes de la paroi vasculaire (vascularite de Shenlein-Henoch, érythème, etc.) et des plaquettes (la plupart des thrombocytopénies), avec troubles de l'hématopoïèse normale (hémorragies avec leucémie, états hypo- et aplasiques de l'hématopoïèse, maladie des rayons), sang -lésion infectieuse des vaisseaux sanguins (fièvres hémorragiques, typhus, etc.), maladies du foie et ictère obstructif (entraînant une violation de la synthèse des facteurs de coagulation sanguine dans les hépatocytes), effet de médicaments qui violent l'hémostase (agents dérégulants, anticoagulants, fibrinolytiques) ou provoquant des troubles immunitaires - thrombocytopénie, vascularite.
Dans bon nombre de ces maladies, les troubles de l'hémostase sont de nature mixte et sont fortement accrus en relation avec le développement secondaire du syndrome DIC, le plus souvent en relation avec des processus infectieux-septiques, immunitaires, destructeurs ou tumoraux (y compris la leucémie).
Symptômes

Le tableau clinique de l'hémophilie est caractérisé par des saignements, qui sont généralement associés à une sorte de traumatisme, à la fois domestique et chirurgical. Le plus souvent, le saignement se développe quelque temps après la lésion tissulaire et se caractérise par une difficulté à l'arrêter. Les saignements peuvent être externes, sous-cutanés, intramusculaires, intra-articulaires et parenchymateux. Les plus traumatisantes sont les hémorragies musculaires et articulaires.
L'hémorragie crânienne est souvent mortelle. Saignements nasaux et gingivaux, hémorragie des muqueuses, saignements ombilicaux des nouveau-nés, métrorragies, saignements de tube digestif et les infections des voies urinaires peuvent survenir avec n'importe quel type d'hémophilie. Chez certains patients, les saignements peuvent être déclenchés par des infections provoquant une inflammation locale (amygdalite, cystite, maladies respiratoires etc.).
Il est important de garder à l'esprit que la sévérité des manifestations hémorragiques uniquement dans les hémophilies A et B a une certaine corrélation avec le niveau de défaut procoagulant. Avec d'autres hémophiles, cela ne peut pas être clairement retracé.
Manifestations de la diathèse hémorragique chez les enfants

La principale manifestation de toute diathèse hémorragique est une augmentation des saignements. Selon les causes de l'événement, on distingue 5 de ses options :
- Hématome... Avec ce type de saignement, tout coup ou chute entraîne une effusion de sang en grande quantité dans les tissus mous, les articulations, les cavités internes et une violation de l'intégrité de la peau ou des muqueuses provoque le développement de saignements sévères. Ce type de saignement est caractéristique de l'hémophilie et des coagulopathies acquises (le sang ne coagule pas pendant très longtemps, par conséquent, des saignements graves surviennent).
- Capillaire(on l'appelle aussi microcirculatoire). Les principales manifestations sont de petites taches de sang (pétéchies et ecchymoses) sur la peau et les muqueuses. Il peut y avoir des saignements du nez, des saignements des gencives. Ce type de saignement se produit principalement avec la thrombocytopénie et la thrombocytopathie.
- Mixte... Dans cette condition, il y a des signes des deux formes précédentes de saignement, c'est-à-dire des hématomes et de petites taches de sang. Une condition survient lorsqu'il y a des violations à la fois de la part du système plaquettaire et de la part des facteurs de coagulation plasmatiques. Par exemple, une image similaire est très caractéristique de la maladie de von Willebrand.
- Angiomateux... Comme son nom l'indique, cette forme de saignement se développe en raison de la pathologie des parois des vaisseaux. Les principales manifestations sont des saignements persistants du nez, des organes du tractus gastro-intestinal (généralement des mêmes vaisseaux).
- Purpurea vasculaire... Le principal problème et la raison de cette variante de saignement sont les dommages immunitaires, toxiques ou allergiques aux petits vaisseaux. Les hémorragies apparaissent le plus souvent de manière symétrique au niveau des grosses articulations, bien qu'une hémorragie interne intense soit également possible. Ce type de saignement est observé dans la maladie de Shenlein-Henoch.
Tous les autres symptômes de la diathèse hémorragique sont dans la plupart des cas le résultat du syndrome hémorragique. Chez les enfants, les articulations peuvent faire mal (en raison de la formation d'hématomes), l'estomac (avec saignement dans le tractus gastro-intestinal), des signes d'anémie (pâleur, faiblesse, vertiges) peuvent apparaître. Si les vaisseaux des reins sont touchés, la couleur de l'urine peut changer. Des troubles neurologiques peuvent également être présents - c'est un signe d'hémorragie cérébrale. En général, l'état d'un enfant atteint de diathèse hémorragique se détériore considérablement chaque jour.
Quand consulter un médecin

Les parents devraient examiner périodiquement leurs enfants pour des ecchymoses. Les gars peuvent avoir quelques bleus sur les tibias, car des membres inférieurs- c'est un endroit très vulnérable, surtout pour les bébés qui ont commencé à marcher activement. De plus, des ecchymoses à un certain endroit peuvent être présentes chez les enfants qui pratiquent un sport (par exemple, le football, la lutte). Si, à part quelques ecchymoses, il n'y a pas d'autres plaintes, il n'y a pas lieu de paniquer.
Mais sonnez l'alarme et contactez pédiatre est obligatoire dans les cas suivants :
- Si des ecchymoses se forment sans raison apparente et dans des endroits inhabituels (les bras et les jambes sont, en règle générale, des endroits communs), par exemple sur le dos, la poitrine, l'abdomen, le visage.
- Si, après des dommages mineurs aux tissus mous, un saignement prolongé se produit.
- Si du sang apparaît dans les selles ou l'urine.
- Si la peau du bébé pâlit.
- Si l'enfant a une fatigue accrue.
Diagnostic de la diathèse hémorragique
Le diagnostic général des maladies et syndromes hémorragiques repose sur les principaux critères suivants :
- détermination du moment d'apparition, de la prescription, de la durée et des caractéristiques de l'évolution de la maladie (apparition dans la petite enfance, l'adolescence ou chez l'adulte et le sujet âgé, développement aigu ou progressif d'un syndrome hémorragique, récent ou à long terme (chronique, récidivant) ) cours, etc. ;
- identification, si possible, d'une genèse familiale (héréditaire) d'hémorragie (avec spécification du type d'hérédité) ou du caractère acquis de la maladie ; clarification du lien possible entre le développement du syndrome hémorragique et les processus pathologiques antérieurs, les influences (y compris les médicaments, les vaccinations, etc.) et les maladies de fond (maladie du foie, leucémie, processus infectieux-septiques, traumatisme, choc, etc.) ;
- détermination de la localisation prédominante, de la gravité et du type de saignement. Ainsi, avec la maladie d'Osler-Randu, les saignements de nez persistants prédominent et sont souvent les seuls ; avec pathologie des plaquettes - ecchymoses, saignements utérins et de nez, avec hémophilie - hématomes profonds et hémorragies dans les articulations.
Un plan d'examen d'un patient atteint d'un syndrome hémorragique est établi par un hématologue en collaboration avec un spécialiste traitant (rhumatologue, chirurgien, gynécologue-obstétricien, traumatologue, infectiologue, etc.).
Tout d'abord, les tests cliniques sanguins et urinaires, la numération plaquettaire, le coagulogramme, les selles de sang occulte sont examinés. En fonction des résultats obtenus et du diagnostic proposé, un laboratoire étendu et diagnostic instrumental(test sanguin biochimique, ponction sternale, trépanobiopsie). Dans la diathèse hémorragique avec immunogénèse, on montre la détermination des anticorps anti-érythrocytes (test de Coombs), des anticorps antiplaquettaires, anticoagulant lupique, etc.. Des méthodes supplémentaires peuvent inclure des tests fonctionnels de fragilité capillaire (garrot, pincement, test de la manchette, etc.) , échographie rénale, échographie du foie; Radiographie des articulations, etc. Pour confirmer le caractère héréditaire de la diathèse hémorragique, il est recommandé de consulter un généticien.
Traitement de la diathèse hémorragique

Avant de commencer le traitement, il est important d'avoir un diagnostic réussi.
Cela peut nécessiter les éléments suivants :
- Réalisation d'analyses générales de laboratoire et biochimiques de sang et d'urine.
- Détermination du temps nécessaire à la coagulation du sang.
- Mener des tests immunologiques, ainsi qu'un test pour la génération de tests de thromboplastine, de prothrombine et de thrombine.
- Examen en laboratoire du sérum sanguin.
- Réalisation d'un coagulogramme.
Après avoir réussi ces examens, le médecin peut poser un diagnostic précis et prescrire le traitement approprié. Cela peut inclure la prise de certains médicaments (par exemple, des suppléments de fer, des corticoïdes) et des complexes et suppléments vitaminiques, ainsi que des méthodes plus radicales : par exemple, une ponction articulaire, une transfusion de plasma ou de globules rouges, ou l'ablation chirurgicale de la rate.
Lors du diagnostic de diathèse hémorragique, il est important de prendre des mesures préventives qui peuvent renforcer le corps et augmenter ses fonctions de protection. Ceux-ci incluent le durcissement, modéré exercice physique et l'exercice, une alimentation équilibrée avec une composition vitaminique soigneusement sélectionnée. De plus, il est particulièrement important de protéger le corps contre la possibilité de contracter des maladies virales pendant la période automne-printemps. Pour cela, il est recommandé de prendre des complexes vitaminiques spécialement sélectionnés.
Lors du choix d'un traitement, une approche différenciée est pratiquée, prenant en compte la forme pathogénique de la diathèse hémorragique. Ainsi, en cas d'augmentation des saignements causée par un surdosage d'anticoagulants et de thrombolytiques, l'annulation de ces médicaments ou leur ajustement posologique est indiqué; la nomination de préparations de vitamine K (vicasol), d'acide aminocaproïque; transfusion de plasma. La thérapie de la diathèse hémorragique auto-immune est basée sur l'utilisation de glucocorticoïdes, d'immunosuppresseurs, de plasmaphérèse; avec un effet instable de leur utilisation, une splénectomie est nécessaire.
En cas de déficit héréditaire de l'un ou l'autre des facteurs de coagulation, un traitement de remplacement avec leurs concentrés, des transfusions de plasma fraîchement congelé, de masse érythrocytaire et un traitement hémostatique sont indiqués. Dans le but d'arrêter localement les saignements mineurs, l'application d'un garrot, d'un pansement compressif, d'une éponge hémostatique, de glace est pratiquée ; effectuer une tamponnade du nez, etc. En cas d'hémarthrose, des ponctions thérapeutiques des articulations sont effectuées; avec des hématomes des tissus mous - leur drainage et l'élimination du sang accumulé.
Les principes de base du traitement du syndrome DIC comprennent l'élimination active de la cause de cette condition; arrêt de la coagulation intravasculaire, suppression de l'hyperfibrinolyse, thérapie de remplacement des hémocomposants, etc.
Complications et pronostic de la diathèse hémorragique

Complications avec diathèse hémorragique dépendent de la localisation des hémorragies. Avec des hémorragies répétées dans les articulations, l'hémarthrose se produit avec la formation d'hématomes étendus dans la zone de passage des gros troncs nerveux, il est possible de comprimer les nerfs avec le développement d'une paralysie, une parésie avec des hémorragies cérébrales, des symptômes caractéristiques de des troubles de la circulation cérébrale apparaissent.
Avec des transfusions répétées de sang et de plasma, une hépatite sérique peut se développer, chez les patients en absence totale de facteurs de coagulation, la formation d'anticorps est possible, ce qui réduit considérablement l'efficacité des transfusions; des réactions post-transfusionnelles sont possibles.